
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уровень А. 1. Реакция между веществами а и в выражается уравнением: а(г) + 2в(г) = 2с(г)
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ И ХИМИЧЕСКОЕ РАВНОВЕСИЕ
1. Реакция между веществами А и В выражается уравнением: А(Г) + 2В(Г) = 2С(Г). Константа скорости этой реакции равна 0,1. Начальные концентрации реагирующих веществ с 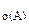 = 0,4 моль/л, с
= 0,4 моль/л, с  = 0,8 моль/л. Вычислить начальную скорость реакции и определить, во сколько раз она изменится, если концентрация вещества А уменьшится на 0,1 моль/л.
= 0,8 моль/л. Вычислить начальную скорость реакции и определить, во сколько раз она изменится, если концентрация вещества А уменьшится на 0,1 моль/л.

| РЕШЕНИЕ:
В простейших одностадийных реакциях скорость пропорциональна концентрациям реагирующих веществ в степенях, равных их стехиометрическим коэффициентам в уравнении реакции:
 = k· = k· · · (5.1) (5.1)
 = k·C = k·C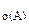 · ·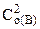 = 0,1∙0,4·0,82 = =0,0256 моль/(л∙с).
Уменьшение концентрации вещества А на 0,1 моль/л сопровождается уменьшением концентрации вещества В на 0,2 моль/л, так как исходные вещества реагируют между собой согласно стехиометрическим коэффициентам в уравнении реакции: = 0,1∙0,4·0,82 = =0,0256 моль/(л∙с).
Уменьшение концентрации вещества А на 0,1 моль/л сопровождается уменьшением концентрации вещества В на 0,2 моль/л, так как исходные вещества реагируют между собой согласно стехиометрическим коэффициентам в уравнении реакции:
|
1моль А – 2 моль В
0,1 моль А – х моль В
х = 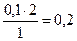 моль.
моль.
Тогда  = 0,1(0,4-0,1)(0,8-0,2)2 = 0,0108 моль/(л·с).
= 0,1(0,4-0,1)(0,8-0,2)2 = 0,0108 моль/(л·с).
В связи с уменьшением концентрации реагирующих веществ в ходе реакции скорость реакции уменьшается:
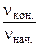
 =
=  .
.
Ответ:  = 0,0256 моль/(л∙с).
= 0,0256 моль/(л∙с).
При уменьшении концентрации вещества А на 0,1 моль/л скорость реакции уменьшилась в 2,37 раза.
2. Как изменится скорость реакции:
2CO(Г) + O2(Г) = 2CO2(Г), если: а) уменьшить давление в системе в 2 раза; б) уменьшить объем системы в 3 раза?

| РЕШЕНИЕ:
На основании закона действующих масс
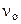 = k· = k·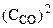 · ·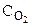 (5.2)
а) уменьшение давления в системе в 2 раза равносильно уменьшению концентраций реагирующих веществ во столько же раз.
Следовательно: (5.2)
а) уменьшение давления в системе в 2 раза равносильно уменьшению концентраций реагирующих веществ во столько же раз.
Следовательно:
|
 = k·
= k· ·
· 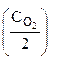 =
=  ·
·  · k·(
· k·(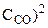 ·
·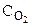 =
= 
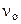 .
.
Тогда:
 =
=  .
.
б) уменьшение объема в системе в 3 раза равносильно увеличению концентрации реагирующих веществ во столько же раз:
 = k·(3
= k·(3 )2·(3
)2·(3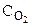 ) = 32·3·k·(
) = 32·3·k·(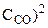 ·
·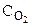 = 27
= 27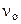 .
.
Тогда:  = 27.
= 27.
Ответ: а) при уменьшении давления в 2 раза скорость реакции уменьшится в 8 раз; б) при уменьшении объема системы в 3 раза скорость реакции увеличится в 27 раз.
3. Энергия активации некоторой реакции равна 60 кДж/моль. Во сколько раз изменится скорость этой реакции:
а) при повышении температуры от 320 до 360К?
б) если она протекает при 298 К в присутствии катализатора (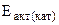 = 48 кДж/моль)?
= 48 кДж/моль)?

| РЕШЕНИЕ:
а) Из уравнения Аррениуса получаем:
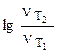 = = 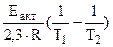
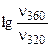 =
= =
= 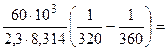 1,09 1,09
|
где 103 – коэффициент пересчета кДж в Дж, тогда
 =101,09 = 12,3 раза;
=101,09 = 12,3 раза;
б) зависимость скорости реакции от наличия катализатора выражается уравнением:
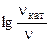 =
= 
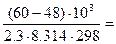 2,11
2,11
откуда 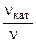 = 102,11 = 129.
= 102,11 = 129.
Ответ:
а) при повышении температуры от 320 до 360К скорость реакции возрастает в 12,3 раза;
б) в присутствии катализатора скорость реакции возрастает в 129 раз.
|
|
Дата добавления: 2014-10-15; Просмотров: 2574; Нарушение авторских прав?; Мы поможем в написании вашей работы!
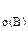 = 0,8 моль/л,
= 0,8 моль/л,