
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уровень a
|
|
|
|
ЭНЕРГЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
1. Определить значения тепловых эффектов Qp и Qv при стандартных условиях для реакции:
H2(г) + ½ O2(г) = Н2О(г) (4.1)
| Дано: Уравнение химической реакции. |
| Qp -? Qv -? |
РЕШЕНИЕ:
Так как приведенное уравнение (4.1) представляет собой процесс образования 1 моль газообразной воды из простых веществ, то тепловой эффект этого процесса (DfHo(298K, Н2О(г)) определяем по таблице стандартных термодинамических величин:
DfHo(298K, Н2О(г)) = - 241,8 кДж/моль или
DrHo(298K) = - 241,8 кДж (для реакции 4.1)
Тогда, учитывая что Qp = -∆Н, Qp = 241,8 кДж
Связь между Qp и Qv выражается уравнением
Qv = Qp + p∆V = Qp + ∆nRT (4.2)
где ∆n = n1 – n2
n1 - cумма числа газовых моль в продуктах реакции
n2 - cумма числа газовых моль в исходных веществах
Для приведенной реакции (4.1) ∆n = 1 – 1,5 = - 0,5 моль.
Определяем значение QV
QV = 241800 – 0,5 · 8,314 · 298 = 240561 Дж ~ 240,6 кДж
Ответ: Qp = 241,8 кДж, Qv = 240,6 кДж
2. Стандартная энтальпия реакции сгорания метанола (СН3ОН) равна (-726,64) кДж/моль. Написать термохимическое уравнение сгорания метанола и вычислить стандартную энтальпию его образования.
| Дано: DflHo(298K, CH3ОН(ж)) = =-726,64 кДж/моль |
| DfHo(298K, CH3ОН(ж)) -? |
РЕШЕНИЕ:
Стандартной энтальпией сгорания вещества DflHo(298K,В) называется тепловой эффект реакции полного сгорания 1 моль органического вещества до СО2(г) и Н2О(ж) при стандартных условиях.
Составляем термохимическое уравнение сгорания 1 моль метанола:
1CH3ОН(ж)+3/2О2(г)=СО2(г)+2Н2О(ж) DflHo(298K)= -726,64 кДж/моль
Следовательно, для данной реакции DrHo(298K) = -726,64 кДж
Для определения DfHo(298K, CH3ОН(ж)) используем первое следствие из закона Гесса для этой же реакции:
DrHo(298K) = 1DfHo(298K, СО2(г)) + 2DfHo(298K,Н2О(ж)) -
- DfHo(298K, CH3ОН(ж)) - 3/2DfHo(298K, О2(г)).
Откуда: DfHo(298K, CH3ОН(ж)) = 1DfHo(298K, СО2(г)) +
+ 2DfHo(298K, Н2О(ж)) - DrHo(298K) – 3/2DfHo(298K, О2(г))
Значения стандартных энтальпий образования (DfHo(298K,В)) веществ берем из таблицы стандартных термодинамических величин.
DfHo(298K, CH3ОН(ж)) = 1(-393,5) +2(-285,8)-(- 726,64) =
= -238,46 кДж/моль.
Ответ: DfHo(298K, CH3ОН(ж)) = -238,46 кДж/моль.
3. Вычислить стандартную энтальпию растворения NaOH в воде, если при растворении 10 г NaOH в 250 мл воды температура раствора повысилась от 200С до 29,70С. Удельная теплоемкость раствора равна 3,99 Дж/(г·К).
Дано:
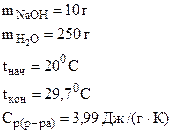
|
| Dраств.Ho(298K, NaOH) -? |
РЕШЕНИЕ:
Стандартную энтальпию растворения рассчитываем по уравнению:
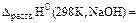
=  , (кДж/моль)
, (кДж/моль)
где МNaOH = 40 г/моль
Qp = mр-ра·Ср(р-ра)·( ), -количество выделившейся теплоты при растворении 10 г NaOH,Дж
), -количество выделившейся теплоты при растворении 10 г NaOH,Дж
QР = (10 + 250)·3,99·9,7 = 10062,8 Дж,
где mр-ра = m + m
+ m = 10+250 = 260 г.
= 10+250 = 260 г.
Для рассматриваемой задачи  = 29,7-20 = + 9,70. При этом следует учесть, что знак "+" указывает на повышение температуры при растворении, а знак "-" - на понижение температуры.
= 29,7-20 = + 9,70. При этом следует учесть, что знак "+" указывает на повышение температуры при растворении, а знак "-" - на понижение температуры.
Dраств.Ho(298K, NaOH) = 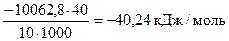 ,
,
1000 - пересчет Дж в кДж.
Ответ: Dраств.Ho(298K, NaOH) = - 40,24 кДж/моль.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 582; Нарушение авторских прав?; Мы поможем в написании вашей работы!