
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
УРОВЕНЬ В. 1. При погружении цинковой пластины в раствор хлороводородной кислоты за одно и то же время при температуре 293 К выделилось 8 см3 водорода
|
|
|
|
1. При погружении цинковой пластины в раствор хлороводородной кислоты за одно и то же время при температуре 293 К выделилось 8 см3 водорода, а при температуре 303 К – 13 см3 водорода. Водород собран над водой при давлении 740 мм рт. ст. Рассчитать энергию активации протекающей реакции. Давление паров воды при температуре 293 К составляет 17,54 мм рт. ст., а при температуре 303 К - 31,82 мм рт. ст.
| РЕШЕНИЕ:
Zn + 2HCl = ZnCl2 + H2↑
Из уравнения
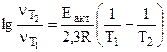 выражаем
энергию активации выражаем
энергию активации
 (5.3) (5.3)
|
Скорость гетерогенной реакции определяем по уравнению:
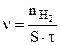 , моль/(см2·мин) (5.4)
, моль/(см2·мин) (5.4)
где 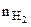 - количество моль выделяющегося водорода;
- количество моль выделяющегося водорода;
S – площадь цинковой пластины, см2;
τ – время протекания реакции, мин.
Определяем отношение скоростей выделения водорода при двух различных температурах (площадь пластины и время протекания реакции постоянны):
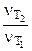 =
=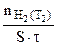 :
: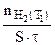 =
=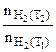 (5.5)
(5.5)
По уравнению Менделеева-Клапейрона
P  V
V 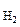 = n
= n 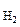 R T, а так как P
R T, а так как P 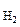 = (Р – P
= (Р – P 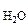 ), то
), то
(P – P 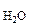 )V
)V 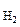 = n
= n 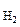 R T, (5.6)
R T, (5.6)
где Р – общее давление газов, мм. рт. ст;
P 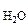 - давление насыщенного водяного пара при температуре опыта, мм. рт. ст.;
- давление насыщенного водяного пара при температуре опыта, мм. рт. ст.;
V 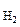 - объем выделившегося водорода, см3;
- объем выделившегося водорода, см3;
Т - температура опыта, К;
R -универсальная газовая постоянная.
Из уравнения (5.6) n 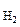 = (Р – P
= (Р – P 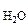 ) V
) V 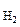 / R T (5.7)
/ R T (5.7)
Подставив выражение (5.7) для температур Т1 и Т2 в отношение (5.5), получим
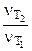 =
= 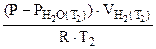 :
: 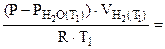
=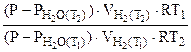
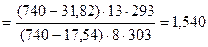
Откуда 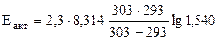 = 31834 Дж/моль =
= 31834 Дж/моль =
= 31,83 кДж/моль
Ответ: 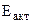 = 31,83 кДж/моль.
= 31,83 кДж/моль.
2. На основании принципа Ле Шателье определить, в каком направлении сместится равновесие:
2SO2(г) + O2(г) <=> 2SO3(г), ΔrH0(298K) = -284,2 кДж, при: а) понижении температуры, б) повышении концентрации SO3, в) повышении давления. Записать выражение для константы равновесия реакции. Ответы обосновать.
Дано:
Уравнение реакции
ΔrH0(298K)=-284,2 кДж
 Определить направление смещения равновесия при изменении Т, Р, С
Определить направление смещения равновесия при изменении Т, Р, С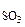
| РЕШЕНИЕ: Выражение константы равновесия реакции может быть приведено в зависимости от равновесных парциальных давле-ний газообразных участников реакции (5.8) или от их равновесных концентраций (5.9): |
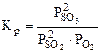 , (5.8)
, (5.8) 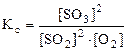 . (5.9)
. (5.9)
а) Выражение зависимости константы равновесия от термодинамических характеристик реакции имеет вид:
-2,3RTlgKP = ΔrH0(298K) – T . ΔrS0(298K), откуда
 . Смещение равновесия реакции при изменении температуры зависит от знака изменения стандартной энтальпии реакции ΔrH0(298K). Так как ΔrH0(298K)<0, то при понижении температуры показатель степени
. Смещение равновесия реакции при изменении температуры зависит от знака изменения стандартной энтальпии реакции ΔrH0(298K). Так как ΔrH0(298K)<0, то при понижении температуры показатель степени 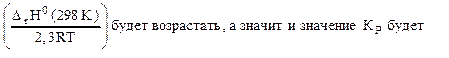 возрастать.
возрастать.
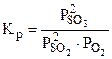 возрастает при увеличении числителя и уменьшении знаменателя, а это возможно при протекании прямой реакции, т.е равновесие 2SO2(г) + O2(г) <=> 2SO3(г) будет смещено вправо (→).
возрастает при увеличении числителя и уменьшении знаменателя, а это возможно при протекании прямой реакции, т.е равновесие 2SO2(г) + O2(г) <=> 2SO3(г) будет смещено вправо (→).
б) Константа равновесия 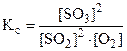 остается величиной постоянной при любом изменении концентрации участников реакции. Поэтому при повышении концентрации SO3 (числитель) при неизменном значении КС должны автоматически возрасти концентрации исходных веществ (знаменатель), а это возможно при протекании обратной реакции, т.е. в этом случае равновесие сместится влево (←).
остается величиной постоянной при любом изменении концентрации участников реакции. Поэтому при повышении концентрации SO3 (числитель) при неизменном значении КС должны автоматически возрасти концентрации исходных веществ (знаменатель), а это возможно при протекании обратной реакции, т.е. в этом случае равновесие сместится влево (←).
в) В соответствии с принципом Ле Шателье увеличение давления смещает равновесие в сторону той реакции, которая сопровождается уменьшением давления или уменьшением суммарного числа моль газообразных веществ.
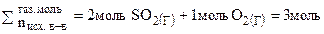 (газ)
(газ)
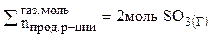 = 2моль(газ)
= 2моль(газ)
Следовательно, при повышении давления равновесие системы смещается вправо (→).
3. Вычислить константу равновесия для гомогенной системы 4NH3(г) +3O2(г) <=> 2N2(г) + 6H2O(г), если исходные концентрации NH3(г) и O2(г) соответственно равны 6,0 и 5,0 моль/л, а равновесная концентрация N2(г) равна 1,8 моль/л.

| РЕШЕНИЕ:
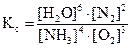 . (5.11)
Расчет количеств прореагировавших и образовавшихся при установлении равновесия веществ проводится по уравнению реакции.
Равновесная концентрация исходных . (5.11)
Расчет количеств прореагировавших и образовавшихся при установлении равновесия веществ проводится по уравнению реакции.
Равновесная концентрация исходных
|
веществ равна разности исходной концентрации и концентрации прореагировавших веществ. Равновесная концентрация продуктов реакции равна количеству образовавшихся продуктов реакции, т.к. в исходном состоянии их количество было равно нулю.
Обозначим через х количество моль прореагировавших или образовавшихся веществ. Тогда с учетом коэффициентов в уравнении реакции отношения концентраций во второй строке под уравнением реакции равны: (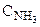 :
: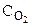 :
: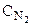 :
: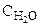 = 4:3:2:6).
= 4:3:2:6).
Последовательность расчетов равновесных концентраций веществ, участвующих в реакции, показана ниже:
| 4NH3 + 3O2 <=> 2N2 + 6H2O | |||||
| Исходная концентрация веществ, моль/л |
 6,0
6,0
| 5,0 | 
|

| |
| Прореагирова-ло, моль/л |
- 4х

|
- 3х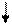
| Образо-валось, моль/л |
+ 2х
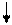
|
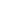 + 6х + 6х

|
| Равновесная концентрация веществ, моль/л | 6,0-4х | 5,0-3х | 2х | 6х |
По условию задачи равновесная концентрация N2 равна 1,8 моль/л. В то же время [N2] = 2х. Следовательно, 2х = 1,8, а х = 0,9. Тогда равновесные концентрации веществ равны, моль/л:
[NH3] = 6,0-4·0,9 = 2,4 моль/л,
[O2] = 5,0-3·0,9 = 2,3 моль/л,
[N2] = 1,8 моль/л,
[H2O] = 6,0·0,9 = 5,4 моль/л.
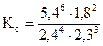 =198,95.
=198,95.
Ответ: Kс = 198,95.
6. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 1383; Нарушение авторских прав?; Мы поможем в написании вашей работы!

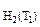 = 8 см3,
= 8 см3,
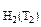 = 13 см3,
P
= 13 см3,
P 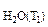 = 21,07 мм рт.ст.
P
= 21,07 мм рт.ст.
P 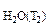 =31,82 мм рт.ст.
P = 740 мм рт.ст.
=31,82 мм рт.ст.
P = 740 мм рт.ст.
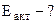 τ
τ

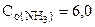 моль/л,
моль/л,
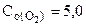 моль/л,
[N2] = 1,8 моль/л
Kс -?
моль/л,
[N2] = 1,8 моль/л
Kс -?