
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
УРОВЕНЬ В. 1. Определить количество моль воды в формуле кристаллогидрата Na2CO3·nH2O, если в результате прокаливания его масса изменилась от 1,43 до 0,53 г
|
|
|
|
1. Определить количество моль воды в формуле кристаллогидрата Na2CO3·nH2O, если в результате прокаливания его масса изменилась от 1,43 до 0,53 г. Определить объем выделившейся парообразной воды при 200оС и давлении 98,2 кПа.
Дано:
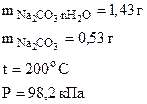
| РЕШЕНИЕ:
При прокаливании кристаллогидрата протекает реакция:
Na2CO3·nH2O 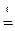 Na2CO3 +nH2O↑(1.1)
Находим массу воды ( Na2CO3 +nH2O↑(1.1)
Находим массу воды (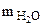 ), выделившейся при разложении кристаллогидрата: ), выделившейся при разложении кристаллогидрата:
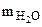 = 1,43 - 0,53 = 0,9 г = 1,43 - 0,53 = 0,9 г
|
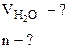
|
Расчет n ведем по уравнению реакции (1.1)
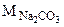 -
- 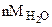 106 г/моль - n18 г/моль
106 г/моль - n18 г/моль
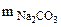 -
-  0,53 г - 0,9 г
0,53 г - 0,9 г
где 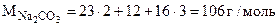
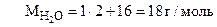
n = 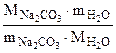 =
=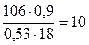
Формула кристаллогидрата Na2CO3·10H2O
Рассчитываем объем выделившейся газообразной воды при
Т = 273 + 200 = 473 К и Р = 98,2 кПа по уравнению Менделеева-Клапейрона
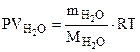
где Р – Па, V – м3, m – кг, М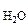 – кг/моль, R – 8,314 Дж/моль·К,
– кг/моль, R – 8,314 Дж/моль·К,
Т – К.
Откуда 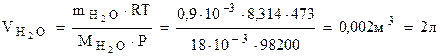 Ответ: формула кристаллогидрата: Na2CO3·10Н2О;
Ответ: формула кристаллогидрата: Na2CO3·10Н2О; 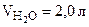 .
.
2. Определить состав смеси (% масс.), содержащей карбонат магния (15 г) и оксид магния. Если после прокаливания смеси, полученный продукт вступил в реакцию с ортофосфорной кислотой и образовалось 80 г ортофосфата магния. Составить уравнения реакций.
Дано:
MgO и MgCO3
m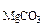 = 15 г
m = 15 г
m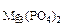 = 80 г = 80 г
| РЕШЕНИЕ:
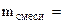 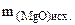 + + 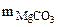
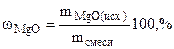 мас. мас.
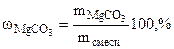 мас. мас.
|
ω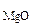 -? ω -? ω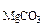 -? -?
|
При прокаливании смеси протекает реакция
MgCO3 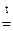 MgO + CO2
MgO + CO2
Тогда по этому уравнению
М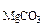 -
-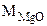 84,3 г/моль - 40,3 г /моль
84,3 г/моль - 40,3 г /моль
m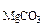 -
- 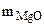 (из MgCO3) 15 г -
(из MgCO3) 15 г - 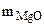 (из MgCO3)
(из MgCO3)
где 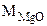 = 24,3 + 16 = 40,3 г/моль
= 24,3 + 16 = 40,3 г/моль
М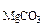 = 24,3 + 12 + 16·3 = 84,3 г/моль
= 24,3 + 12 + 16·3 = 84,3 г/моль
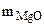 (из MgCO3) =
(из MgCO3) = 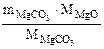 =
=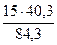 = 7,17 г
= 7,17 г
После прокаливания смесь состоит только из MgО
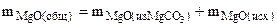
При взаимодействии продукта, полученного после прокаливания с ортофосфорной кислотой, протекает реакция
3MgO(общ.) + 2H3PO4 = Mg3(PO4)2 + 3H2O
3МMgО ________ М 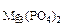
 mMgO(общ) 80 г
mMgO(общ) 80 г
тогда
 3∙ 40,3г/моль 262,9 г/моль
3∙ 40,3г/моль 262,9 г/моль
 mMgO(общ) 80 г
mMgO(общ) 80 г
где МMgО = 40,3 г/моль, М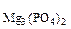 = 262,9 г/моль
= 262,9 г/моль
откуда mMgO(общ) = 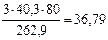 г
г
тогда
mMgO(исх) = mMgO(общ) – mMgO (из MgCO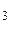 ) = 36,79 г – 7,17 г = 29,62 г
) = 36,79 г – 7,17 г = 29,62 г
Таким образом
mсмеси = mMgO(исх) + 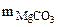 = 29,62 г + 15 г = 44,62 г
= 29,62 г + 15 г = 44,62 г
Состав исходной смеси
ω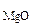 =
= 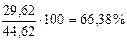 мас.
мас.
ω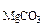 = 100 – 66,38 = 33,62% масс.
= 100 – 66,38 = 33,62% масс.
3. При взаимодействии 1,8 г технического карбоната кальция (мела) с HCl выделилось 400 см3 CO2, собранного над водным раствором NaHCO3 и измеренного при температуре 288 К и давлении 730 мм рт.ст. Давление паров воды при 288 К равно 12,79 мм рт.ст. Определить содержание СаСО3 в техническом карбонате кальция в процентах.
Дано:
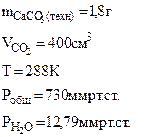
 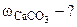
| РЕШЕНИЕ:
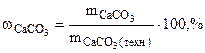 Так как, примеси, содержащиеся в техническом СаСО3 не взаимодействуют с HCl с образованием CO2, то массу чистого карбоната кальция (
Так как, примеси, содержащиеся в техническом СаСО3 не взаимодействуют с HCl с образованием CO2, то массу чистого карбоната кальция (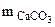 )
определяем по уравнению реакции (1.4): )
определяем по уравнению реакции (1.4):
|
СаСО3 +2HCl=CaCl2 + H2O+CO2↑ (1.4)

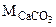 22400 cм3 (н.у.)
22400 cм3 (н.у.)

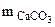
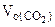
Находим 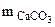
 100 г/моль 22400 см3
100 г/моль 22400 см3

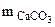
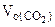
где 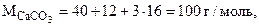
откуда 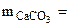
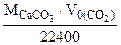 (1.5)
(1.5)
где 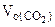 - объем выделившегося СО2, приведенный к нормальным условиям.
- объем выделившегося СО2, приведенный к нормальным условиям.
 Для определения
Для определения 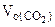 воспользуемся объединенным газовым законом:
воспользуемся объединенным газовым законом:
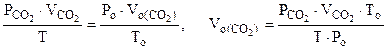
где 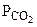 - парциальное давление СО2, так как СО2 собран над водным раствором NaHCO3, то
- парциальное давление СО2, так как СО2 собран над водным раствором NaHCO3, то
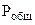 =
= 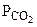 +
+ 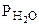 , тогда
, тогда
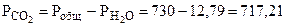 мм рт.ст.
мм рт.ст. 
Тo = 273 К,
Рo = 760 мм рт. ст.,
тогда 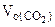 =
= 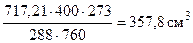
Определяем массу чистого СаСО3 по формуле (1.5):
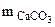 =
= 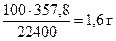 , тогда
, тогда
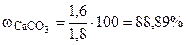
Ответ: содержание СаСО3 в меле 88,89%.
2. ЭКВИВАЛЕНТ. ЗАКОН ЭКВИВАЛЕНТОВ
УРОВЕНЬ А
1. Трехвалентный элемент образует оксид, содержащий 68,90% масс. кислорода. Вычислить молярную массу эквивалента элемента и назвать элемент.

| РЕШЕНИЕ:
По закону эквивалентов:
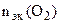 = = 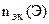
 
|
Мэк(Э) = 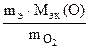 , где Мэк(О) = 8 г/моль
, где Мэк(О) = 8 г/моль
mокс = mэ + 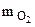
mэ = 100 - 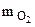 = 100 – 68,9 = 31,1 г.
= 100 – 68,9 = 31,1 г.
Мэк(Э) = 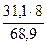 = 3,61 г/моль
= 3,61 г/моль
Мэк(Э) =  , где В – валентность элемента.
, где В – валентность элемента.
Мэ = Мэк(Э) ∙ В = 3,61 ∙ 3 = 10,83 г/моль, что соответствует молекулярной массе атома бора.
Ответ: Мэк(Э) = 3,61 г/моль; элемент – В.
2. На восстановление 7,2 г оксида потребовалось 2,24 л водорода, измеренного при н.у. Рассчитать молярные массы эквивалентов оксида и металла. Назвать этот металл.

| РЕШЕНИЕ:
По закону эквивалентов
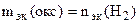

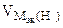 = 11,2 л/моль = 11,2 л/моль
|
МЭК(Окс) = 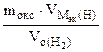 =
= 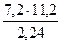 = 36 г/моль
= 36 г/моль
МЭК(Окс) = МЭК(Ме) + МЭК(О)
МЭК(Ме) = МЭК(Окс) – МЭК(О) = 36 - 8 = 28 г/моль
МЭ = МЭК(Ме) · В
Если В = 1 МЭ = 28 г/моль. Такого металла в таблице Д.И. Менделеева нет. Если В = 2 МЭ = 56 г/моль. Следовательно, Ме - Fe
Ответ: Мэк(Окс) = 36 г/моль, Мэк(Ме) = 28 г/моль, Ме – Fe
3. Хлорид некоторого металла массой 0,493 г обработали избытком раствора AgNO3. При этом образовалось 0,95 г AgCl. Вычислить молярную массу эквивалента металла и назвать этот металл.

| РЕШЕНИЕ:
По закону эквивалентов:
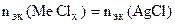 т.е. т.е.
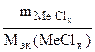 = = 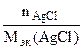
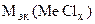 = = 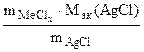
|
где х – валентность Ме, т.к. заряд хлорид иона равен – 1.
МЭК (AgCl) = 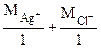 = 108 + 35,5 = 143,5 г/моль
= 108 + 35,5 = 143,5 г/моль
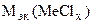 =
= 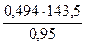 = 74,62 г/моль
= 74,62 г/моль
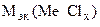 =
= 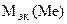 +
+ 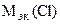
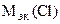
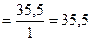 г/моль
г/моль
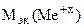 =
= 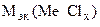 -
- 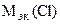
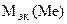 = 74,62 –35,5 = 39,12 г/моль.
= 74,62 –35,5 = 39,12 г/моль.
МЭ = МЭК(Ме) · В. Если х = В = 1, то МЭ = 39,12 г/моль, что соответствует молярной массе атома калия.
Ответ: 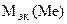 = 39,12 г/моль, Ме - К
= 39,12 г/моль, Ме - К
УРОВЕНЬ В
1. При растворении 16,25 г двухвалентного металла в кислоте выделилось 6,52 л водорода, собранного над водой и измеренного при температуре 298К и давлении 730 мм рт. ст. Определить молярную массу эквивалента металла и назвать металл. Давление паров воды при температуре 298К равно 23,76 мм рт. ст.

| РЕШЕНИЕ:
По закону эквивалентов
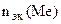 = = 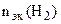
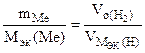 Мэк(Ме) =
Мэк(Ме) = 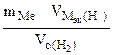 = =
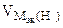 = 11,2 л/моль = 11,2 л/моль
|
По объединенному уравнению газового состояния
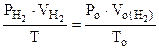
где: То = 273 К, Ро = 760 мм рт.ст.
Робщ = 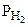 +
+ 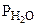 ;
; 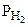 = Робщ -
= Робщ - 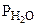
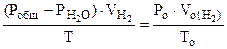
определяем 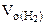
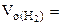
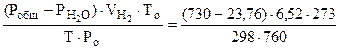 =
=
= 5,55 л
Мэк(Ме) = 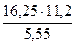 =32,79 г/моль
=32,79 г/моль
Мэк(Ме) = 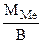 , г/моль, где В – валентность металла
, г/моль, где В – валентность металла
ММе = Мэк(Ме) ∙ В = 32,79 ∙ 2 = 65,58 г/моль, что соответствует молекулярной массе атома цинка.
Ответ: Мэк(Zn) = 32,79 г/моль, металл – Zn
2. При окислении металла израсходовано 3,79 л кислорода, измеренного при 293 К и давлении 740 мм рт.ст. Образовалось 39,43 г оксида. Определить молярные массы эквивалентов металла и оксида. Назвать металл.
 
| РЕШЕНИЕ:
По закону эквивалентов
nэк (окс) = nэк(О2)
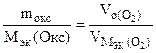 Мэк(Окс) =
Мэк(Окс) = 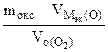
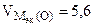 л/моль л/моль
|
По объединенному уравнению газового состояния
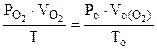
где: ТО = 273 К, РО = 760 мм рт.ст.
определяем 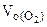
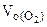 =
= 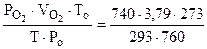 = 3,44 л.
= 3,44 л.
Мэк(Окс) = 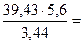 64,2 г/моль
64,2 г/моль
Мэк(Окс) = Мэк(Ме) + Мэк(О)
Мэк(Ме) = Мэк(Окс) - Мэк(О)
Мэк(Ме) = 64,2 – 8 = 56,2 г/моль
ММе = Мэк(Ме) ∙ В. Если В = 1, то МЭ = 56,2 г/моль. Такого металла в таблице Д.И. Менделеева нет. Если В = 2, то ММе = 112,4 г/моль. Следовательно, металл - кадмий
Ответ: Мэк(Окс) = 64,2 г/моль
Мэк(Ме) = 56,2 г/моль
Ме – Cd
3. Написать уравнения реакций взаимодействия гидроксида железа (III) с хлороводородной кислотой с образованием:
а) хлорида дигидроксожелеза (III);
б) хлорида гидроксожелеза (III);
в) хлорида железа (III).
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 2844; Нарушение авторских прав?; Мы поможем в написании вашей работы!
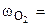 68,90% асс.
В = 3
Мэк(Э) -?
Э -?
68,90% асс.
В = 3
Мэк(Э) -?
Э -?
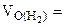 2,24 л
Мэк(Окс.) -?
Мэк(Ме) -? Ме -?
2,24 л
Мэк(Окс.) -?
Мэк(Ме) -? Ме -?
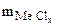 =0,494г
=0,494г
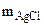 = 0,95 г
Mэк(Me) -?
Me -?
= 0,95 г
Mэк(Me) -?
Me -?
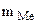 =16,25 г
В = 2
=16,25 г
В = 2
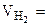 6,52 л
Т = 298 К
Робщ = 730 мм рт.ст
6,52 л
Т = 298 К
Робщ = 730 мм рт.ст
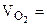 3,79 л
Т = 293 К
3,79 л
Т = 293 К
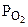 = 740 мм рт.ст.
Мэк(Окс) -?
Мэк(Ме) -?
Ме -?
= 740 мм рт.ст.
Мэк(Окс) -?
Мэк(Ме) -?
Ме -?