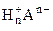КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
УРОВЕНЬ А. Ich kann ein Modalverben im Präteritum bilden und im Satz identifizieren;
|
|
|
|
ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Reflexion
Das kann ich…
Ich kann ein Modalverben im Präteritum bilden und im Satz identifizieren;
Sie haben heute fleißig gearbeitet. Ich danke Ihnen.
Sie haben heute fleißig gearbeitet. Ich bedanke mich bei Ihnen.
3. Hausaufgabe
Schriftliche Übung

|
 |  | ||
NO, CO, SiO, N2O
|
|
|
Основные:Кислотные:
Li2O - оксид лития; В2О3 - оксид бора;
MgO - оксид магния; СО2 - оксид углерода(IV);
МnО - оксид марганца(II). Mn2О7 - оксид марганца(VII)
FeO –оксид железа (II) CrO3 –оксид хрома (VI)
Амфотерные
BeO - оксид бериллия; ZnO - оксид цинка;
Al2O3 - оксид алюминия; SnO - оксид олова (II);
Cr2O3 - оксид хрома (III); PbO - оксид свинца (II).
СВОЙСТВА ОКСИДОВ:
Основные:
CaO + СО2 = СаСO3
СuО + H2SO4 = CuSO4 + Н2О;
Na2O +H2O=2NaOH;
СuО + H2 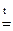 Cu + Н2О Cu + Н2О
| Кислотные: СО2 + СuО = СuСO3 СО2 + NaOН = NaHCO3 СО2 + Ва(ОН)2 = = ВаСО3↓ + Н2О SO3 + Н2О = H2SO4; |
Амфотерные:
ZnO + 2HCl = ZnCl2 + H2O;
ZnO + 2 NaOH 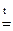 Na2ZnO2 + H2O;
Na2ZnO2 + H2O;
цинкат натрия
ZnO + 2 NaOH + H2O = Na2[Zn(OH)4];
тетрагидроксоцинкат натрия
Al2О3 + 6HCI = 2A1CI3 +3H2O;
А12О3 + Na2CO3  2NaAlO2 + CO2;
2NaAlO2 + CO2;
А12О3 + 2NaOH  2NaAlO2 + H2O.
2NaAlO2 + H2O.
метаалюминат натрия
А12О3 + 2NaOH + 3 H2O = 2Na[Al(OH)4]
тетрагидроксоалюминат натрия
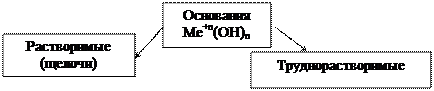
| LiOH - гидроксид лития; NaOH - гидроксид натрия; КОН - гидроксид калия; RbOH - гидроксид рубидия; CsOH - гидроксид цезия; Са(ОН)2 -гидроксид кальция; Sr(OH)2 - гидроксид стронция; Ва(ОН)2 - гидроксид бария; | Fe(OH)2- гидроксид железа (II);
Mg(OH)2 - гидроксид магния
Амфотерные гидроксиды:
Zn(OH)2 = H2ZnO2
гидроксид цинковая
цинка кислота
   А1(ОН)3 = Н3АlO3 = НАlO2 + Н2О
гидроксид ортоалю- метаалю-
алюминия миниевая миниевая
кислота кислота А1(ОН)3 = Н3АlO3 = НАlO2 + Н2О
гидроксид ортоалю- метаалю-
алюминия миниевая миниевая
кислота кислота
|
СВОЙСТВА ОСНОВАНИЙ
Cu(OH)2 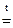 CuO + H2O.
CuO + H2O.
КОН +HCl = KCl + H2O;
Са(ОН)2 + CO2 = CaCO3↓ + H2O;
2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4;
Al(OH)3 + 3HCl = AlCl3 + 3H2O;
Al(OH)3 + NaOH 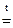 NaAlO2 + 2H2O;
NaAlO2 + 2H2O;
метаалюминат натрия
Al(OH)3 + 3NaOH 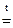 Na3AlO3 + 3H2O;
Na3AlO3 + 3H2O;
ортоалюминат натрия
Al(OH)3 + NaOH = Na[Al(OH)4];
тетрагидроксоалюминат натрия
Al(OH)3 + 3NaOH = Na3[Al(OH)6];
гексагидроксоалюминат натрия
|
 | |||
 | |||
| HF - фтороводородная HCl - хлороводородная; HJ - иодоводородная; НВг - бромоводородная; H2S - сероводородная; HCN - циановодородная. HSCN - родановодородная | H3BО3 - ортоборная; HBО2 - метаборная Н2СО3 - угольная; H4SiO4 - ортокремниевая, H2SiO3 - метакремниевая НNO3 - азотная; HNO2 - азотистая; Н3РО4 - ортофосфорная; НРО3 - метафосфорная; H2SO4 - серная; Н2SОз - сернистая; НМnО4 - марганцовая; НClO4 - хлорная; CH3COOH - уксусная; HCOOH –муравьиная |
СВОЙСТВА КИСЛОТ:
2НС1 + СаСO3 = СaCI2 + H2O + CO2↑;
2HC1 + Zn = ZnCI2 + H2↑;
H2SO4 + CuO = CuSO4 + H2O;
H2SO4 + Ba(OH)2 = BaSO4↓ + 2H2O;
H2SO4 + K2SiO3 = H2SiO3↓ + K2SO4;
HC1 + AgNO3 = AgCl↓ + HNO3.
H2 SiO3 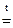 H2O + SiO2
H2O + SiO2
H2SO3 = H2O + SO2
 | |||
 | |||
| 2NaOH + H2SO4 = Na2SO4 + 2H2O; K2SO3 –сульфит калия; Na2SO4 - сульфат натрия; Ni(NO3)2 - нитрат никеля (II); Fe(NO2)3 – нитрит железо (III); K2S - сульфид калия; NH4Cl – хлорид аммония. Сa3(PO4)2 – ортофосфат кальция; КPO3 – метафосфат калия; Na2SiO3 – метасиликат натрия | Fe(OH)3 + 2HNO3 = = FeOH(NO3)2 + 2H2O (CuOH)2SO4 - сульфат гидроксомеди(II); Fe(OH)2NO3 – нитрат дигидроксожелеза (III); ZnOHСl – хлорид гидроксоцинка. |
|
 |
2H3РO4 + Ba(OH)2 = Ba(H2PO4)2 + 2H2O
KHSO3 - гидросульфит калия;
А1(Н2РО4)3 - дигидроортофосфат алюминия
Ca(HCO3)2 – гидрокарбонат кальция;
NaHS – гидросульфид натрия;
SrHPO4 – гидроортофосфат стронция.
Таблица 1.1. Кислоты и их соли.
| Формула кислоты | Формула аниона | Название аниона |
| HBO2 | BO2- | Метаборат |
| H3BO3 | BO33- | Ортоборат |
| Н2SO4 | SO42- | Сульфат |
| H2 SO3 | SO32- | Сульфит |
| HNO3 | NO3- | Нитрат |
| HNO2 | NO2- | Нитрит |
| H2CO3 | CO32- | Карбонат |
| H2SiO3 | SiO32- | Метасиликат |
| H3PO4 | PO43- | Ортофосфат |
| HPO3 | PO3- | Метафосфат |
| HMnO4 | MnO4- | Перманганат |
| HF | F- | Фторид |
| HСl | Cl- | Хлорид |
| HBr | Br- | Бромид |
| HI | I- | Иодид |
| H2S | S2- | Сульфид |
| HCN | CN- | Цианид |
| CH3COOH | CH3COO- | Ацетат |
| HCOOH | HCOO- | Формиат |
СВОЙСТВА СОЛЕЙ
Hg(NO3)2 + Zn = Zn(NO3)2 + Hg;
CuSO4 + 2 NaOH = Cu(OH)2↓ + Na2SO4;
Fe(NO3)2 + H2S = FeS↓ + 2HNO3;
CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl;
KHSO4+ KOH = K2S04 + H2O;
CuOHCl + HCl = CuCI2 + H2O;
CuSO4·5H2O  CuSO4 + 5H2O.
CuSO4 + 5H2O.
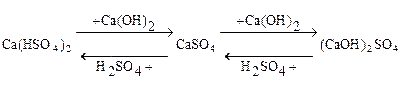
НЕКОТОРЫЕ ПРАВИЛА ОПРЕДЕЛЕНИЯ СТЕПЕНЕЙ ОКИСЛЕНИЯ ЭЛЕМЕНТОВ В ХИМИЧЕСКИХ СОЕДИНЕНИЯХ.
1. Степень окисления атомов в простых веществах равна нулю.
Например; Н2°; N2°, О2°, Na°, Cu°, Fe°, Hg°, Sо, P°, B° и др.
2. Атомы кислорода в основных классах неорганических соединений проявляют степень окисления (-2).
Например: Са+2О-2,S+4O2-2 и т.д.
Исключения: фторид кислорода О+2 F2-1 - степень окисления кислорода (+2), пероксиды - степень окисления кислорода (-1),
Например: Н2+1 О2-1, Ca+2 O2-1.
3. Атом водорода в основных классах неорганических соединений проявляет степень окисления (+ 1).
Например: H2+1S-2, N-3H3+1, Н2+1О-2, K+1O-2H+1, Na+1H+1C+4O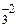 .
.
Исключения: гидриды металлов типа Ca+2H2-1; Na+1H-1; в которых степень окисления водорода (-1).
4. Металлы IA, IIА и IIIA главных подгрупп Периодической системы проявляют степень окисления равную номеру группы в которой находится этот элемент т.е. соответcтвенно (+1), (+2) и (+3) (см. табл.1.2).
Например: Na2+1O-2; Sr+2O-2; Al2+3O3-2.
5. Алгебраическая сумма степеней окисления отдельных атомов, образующих молекулу, с учетом их стехиометрических индексов равна нулю. Например, можно определить степень окисления азота в молекуле НNO3, зная степени окисления кислорода (-2) и водорода (+1): H+1NхО3-2
(+1) + х +(-2)·3 = 0; х = +5
или степень окисления хрома в молекуле К2+1Cr2хО7-2:
(+1) · 2 + х · 2 + (-2)·7 = 0 х = +6
6. Атомы одного и того же элемента в различных соединениях могут иметь разные степени окисления, например:
K+1Mn+7O4-2; H2+1Mn+6O4-2; Mn+4O2-2.
Таблица 1.2. Элементы, имеющие постоянную степень окисления в большинстве соединений
| I | II | III | IV | V | VI |
| H+ | |||||
| Li+1 | Be+2 | B+3 | O-2 | ||
| Na+1 | Mg+2 | Al+3 | |||
| K+1 | Ca+2 Zn+2 | Sc+3 | |||
| Rb+1 Ag+1 | Sr+2 Cd+2 | ||||
| Cs+1 | Ba+2 | ||||
| Fr+1 | Ra+2 |
1. а) Назвать следующие химические соединения и определить степень окисления всех элементов соединений: СО, Mn(OH)2, H2SO4, KHS, Na2CO3, FeOH(NO3)2.
б) Написать формулы следующих химических соединений: оксид свинца (IV), сульфат лития, хлорид гидроксоцинка, дигидроортофосфат алюминия
Ответ:
а) С+2О-2 - оксид углерода (II),
Mn+2 (O-2H+1)2 - гидроксид марганца (II),
Н+12S+4O-23 - сернистая кислота,
К+1Н+1S-2 - гидросульфид калия,
Na2+1С+4О-23 - карбонат натрия,
Fe+3O-2H+1(N+5O-23)2 - нитрат гидроксожелеза (III).
б) Оксид свинца (IV) - PbO2,
сульфат лития - Li2SO4,
хлорид гидроксоцинка – ZnOHCl
дигидроортофосфат алюминия – Al(H2PO4)3
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 520; Нарушение авторских прав?; Мы поможем в написании вашей работы!