
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Особенности агрегативной устойчивости лиофобных дисперсных систем и структурно-механический барьер
|
|
|
|
В лиофобных системах частицы дисперсной фазы слабо взаимодействуют с молекулами дисперсионной среды. У лиофильных систем, наоборот, подобное взаимодействие максимальное. Лиофильные системы, для которых соблюдается условие (10.25), термодинамически устойчивы и не нуждаются в коллоидной защите. Лиофобные системы неустойчивы. Их устойчивость может быть сохранена искусственно. Одна из таких возможностей определяется теорией ДЛФО.
Между типично лиофильными и типично лиофобными системами находится большое число промежуточных дисперсных систем, которые обладают различной термодинамической устойчивостью в зависимости от полярности дисперсной фазы и дисперсионной среды, концентрации и размера частиц. Агрегативная устойчивость определяется временем протекания тех процессов, которые вызваны избытком поверхностной энергии. Поэтому агрегативная устойчивость имеет кинетический характер, т.е. определяется временем и скоростью коагуляции.
Скорость коагуляции, которая в соответствии с условием (10.12) характеризует изменение во времени численной концентрации, зависит от вероятности слипания e [см, формулу (10.17)]. Вероятность слипания определяет долю слипшихся частиц по отношению к числу соприкоснувшихся частиц. С учетом баланса сил отталкивания и притяжения, согласно теории ДЛФО, можно определить во сколько раз уменьшится скорость коагуляции:
кс= 1/ e; (10.43)
ксназывают коэффициентом стабильности, который следует рассматривать как отношение констант скорости медленной кми быстрой кбкоагуляции, т.е. кс= км/кб; данное отношение и является мерой стабильности дисперсных систем.
Коэффициент стабильности как величина, обратная вероятности слипания, позволяет связать теоретические представления Смолуховского (см. параграф 10.3), которые абстрагируются от условий взаимодействия между частицами, с возникновением сил притяжения и отталкивания, т.е. с причинами коагуляции.
Агрегативная устойчивость может быть сохранена в результате внешнего воздействия на лиофобные системы. К числу внешних воздействий относятся ультразвуковое и электрическое поле высокого напряжения, механическое перемешивание и изменение температуры. Коагуляция интенсифицируется под действием различных излучений: светового, лазерного, рентгеновского, радиоактивного.
Сохранить агрегативную устойчивость дисперсных систем можно путем лиофилизации поверхности раздела фаз за счет снижения поверхностного натяжения. Это достигается адсорбцией и образованием на границе раздела фаз адсорбционных слоев молекул ПАВ (см. рис. 6.4), ионов и других веществ.
Устойчивость дисперсных систем определяют гидрофобные взаимодействия (параграф 5.5). На гидрофобных частицах, таких как фторопласт, парафин и других, маловероятны возникновение электрического заряда и образование ДЭС. Коагуляция и стабилизация дисперсных систем с гидрофобной дисперсной фазой приобретает определенную специфичность. В этом случае электролиты не могут оказывать заметного действия на коагуляционные процессы.
Регулировать процессы коагуляции и стабилизации таких дисперсных систем можно, вводя добавки ПАВ и изменяя температуру среды. Стабилизация достигается вследствие взаимодействия между гидрофобными частицами и молекулами ПАВ. С повышением температуры дисперсионной среды коагуляция усиливается; наоборот, снижение температуры повышает устойчивость дисперсной системы при добавке ПАВ.
Важным фактором агрегативной устойчивости является структурно-механический барьер. Речь идет об адсорбционном слое, образованном молекулами ПАВ или макромолекулами высокомолекулярных соединений. Эти адсорбционные слои формируются из длинноцепочечных молекул. При перекрытии адсорбционных слоев образуется структура, которая приобретает определенную упругость и прочность. Возникает структурно-механический барьер, который является дополнительным фактором устойчивости дисперсных систем.
Адсорбционные слои могут быть окружены сольватной оболочкой, состоящей из ориентированных полярных молекул дисперсионной среды, чаще — воды (см. рис. 10.7). Адсорбционные слои превращаются в адсорбционно-сольватные. Такие слои могут обладать повышенной прочностью. Так, например, прочность адсорбционно-сольватных белковых слоев на границе воды с угловодородной жидкостью в 100—1000 раз выше, чем прочность этих слоев на границе с воздухом. Адсорбционные слои некоторых ПАВ и BMС (глюкозиды, белки, производные целлюлозы и другие) образуют структуры, обладающие упругостью и прочностью, и одновременно лиофилизуют поверхность частиц, которая из лиофобной становится лиофильной, что также способствует устойчивости дисперсных систем (см. параграф 10.4). Взаимодействие между молекулами сольватной оболочки может изменить свойства адсорбционных слоев и их влияние на устойчивость дисперсных систем. При определенной ориентации молекул сольватной оболочки (такая ориентация показана на рис. 10.7) возникает дополнительная сила отталкивания 7 за счет одноименных зарядов полярных молекул. Сольватная оболочка может образовываться между молекулами внутри адсорбционного слоя. В результате также возникает сила отталкивания, что нарушает структуру адсорбционного слоя, снижает его прочность и структурно-механические свойства.
Итак, сольватная оболочка может либо увеличить, либо снизить защитные действия адсорбционных слоев и тем самым оказывать влияние на устойчивость дисперсных систем.
В качестве заключения отметим, что устойчивость дисперсных систем зависит от многих факторов. В реальных системах следует рассматривать эти факторы в совокупности, поэтому проблема оценки устойчивости реальных систем является чрезвычайно сложной.
Упражнения
1. Определить скорость оседания частиц радиусом 10 мкм, образующихся после помола зерен кофе в воде (η = 1,0.10–3Па∙с) и в воздухе (η = 1,81.10–7Па∙с); плотность кофе r = 1,1∙103кг/м3, воды и воздуха при 293 К 1∙103кг/м3и 1,205 кг/м3соответственно.
Из формулы (10.8) следует
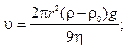
в водной среде
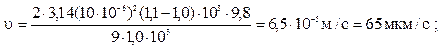
в воздушной среде (ρ0= 0)
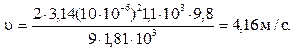
2. Рассчитать среднее время половинной коагуляции θсрдля высокодисперсной суспензии коалина с учетом следующих данных:
Время коагуляции, с 0 105 255 420
Численная концентрация, 10 -14м–3 5,0 3,90 2,92 2,26
Из уравнения (10.16) следует
θ = vчττ/(vч0– vчτ).
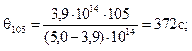
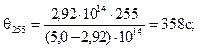

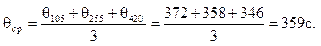
3. Определить константу скорости коагуляции золя иодида серебра AgI, если его начальная численная концентрация составляет 3,2∙1014м–3, а время половинной коагуляции θ = 11,.5 с.
По формуле (10.13) находим
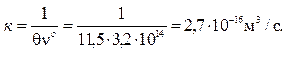
4. Определить вид коагуляции (быстрая или медленная) путем сопоставления констант скорости коагуляции, полученных расчётным и экспериментальным путем, для золя серы, коагулируемого раствором хлорида алюминия (при t = 293 К):
Время коагуляции, с 0 1 4 10
Численная концентрация, 10-17м–3 16,0 1,78 0,50 0,20
По формуле (10.19) рассчитываем тооретическое значение константы скорости коагуляции:

Согласно формуле (10.16) 

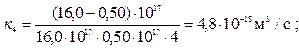

кэкс< ктеор, т.е. выполняется условие (10.20), соответствующее медленной коагуляции.
5. Как изменится порог коагуляции золя As2S3, если для коагуляции 10∙10–6м3золя потребуется, 1,2∙10–6м3раствора NaCl концентрацией 0,5 кмоль/м3? Определите порог коагуляции под действием раствора MgCl2, концентрацией 0,036 кмоль/м3(его потребуется 0,4∙10–6м3на 10∙10–6м3золя) и раствора AlСl3, концентрацией 0,01 кмоль/м3(его потребуется 0,1∙10–6м3 на 10. 10–6м3золя). Проверить выполнение условия (10.41).
Воспользуемся формулой (10.42) 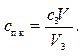
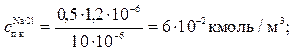


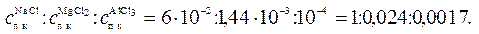
Из полученных данных следует, что условие (10.41) удовлетворительно выполняется.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 2091; Нарушение авторских прав?; Мы поможем в написании вашей работы!