
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основания. Основные классы неорганических соединений
|
|
|
|
Оксиды
Основные классы неорганических соединений
Канон врачебного искусства».
Обережный Круг».
Трансформация негативных эмоций. Избавление от страха».
Наследие предков. Обретение силы Рода».
Великая сила жизни».
18. «Рецепты Судьбы. Учебник хозяина жизни-2»
Готовятся к выпуску следующие книги:
Для записей
Методические советы
Свойства химических соединений в первую очередь определяются их составом, поэтому надо четко разбираться в закономерностях составления простых химических формул, отражающих этот состав. Основной принцип составления формулы молекулы — подбор таких соотношений атомов или групп атомов, чтобы обеспечить электронейтральность молекулы.
Важнейшими классами неорганических соединений являются оксиды, основания, кислоты и соли.
Наиболее простыми соединениями являются соединения из двух элементов (бинарные). Названия таким веществам дают по названию неметалла, образующего такое соединение, с прибавлением суффикса — ид. Если в соединении два неметалла, то, как правило, для составления названия берут название более активного неметалла. Таким образом среди бинарных соединений мы различаем гидриды (NаН, СаН2), галогениды: хлориды, бромиды, фториды (NaС1, КВг, СаF2), оксиды (Na2O, 502), нитриды (ВN) и т. д. Для процессов, имеющих место в живых организмах и в почвах, наибольшее значение имеют вещества, образующие соединения с водой. Примером таких бинарных веществ являются оксиды. Классификация остальных рассмотренных ниже неорганических соединений (кислоты, основания, соли) по характеру их диссоциации рассматриваются в непосредственной связи со свойствами оксидов.
Принципы классификации имеют особое значение в естественных науках. Изучая классы неорганических соединений выделяйте признак или свойство, положенное в основу классификации.
Оксиды — это продукты соединения элемента с кислородом, в которых кислород имеет степень окисления 2~. Например:
1+ 2+ 3+ 4+ 5+ 6 + 7+
Nа2O, СаО, А12O3 , СO2 , Р205 , S03 , Мn2O7.
На примере оксидов удобно вспомнить составление формул по валентности.
Глубокому пониманию принципов составления формул по валентности участвующих в соединении элементов способствует графическое изображение формул.
При составлении графической формулы каждый атом обозначается символом своего элемента, а каждая валентная связь между атомами — черточкой. Таким образом, химических знаков элемента в графическом изображении столько, сколько соответствующих атомов.
Перед построением графической формулы целесообразно определить степень окисления атомов, входящих в состав молекулы.
Как правило, можно соединять только атом, имеющий положительную степень окисления, с атомами, имеющими отрицательные степени окисления.
Так, в молекуле СO2 атом углерода имеет заряд 4+, кислород 2- (вся молекула должна быть электронейтральной).

 Поэтому, от С должно исходить 4 черточки —С—.
Поэтому, от С должно исходить 4 черточки —С—.
В электронейтральной молекуле все валентные связи должны быть «замкнуты». Значит, два атома О «замкнут» по две черточки каждый: 0 = С = 0. Графическая формула показывает, в каком порядке и каким количеством валентных связей атомы связаны друг с другом.
Продукты соединения оксидов с водой, полученные непосредственно или косвенным путем, называют гидроксидами. В зависимости от их свойств в водных растворах гидроксиды делят на основания, амфотерные основания и кислоты. Вода, слабый электролит, способна диссоциировать по уравнению Н2О = Н+ + ОН- В зависимости от того, какие ионы образуются при диссоциации гидроксидов, и проводится их разделение на классы.
Основания обра- Амфотерные ос- Кислоты образуют
зуют анионы ОН- нования образу- катионы Н+ также,
так же, как ани- ют как ион Н+, как и катионы воды
оны воды так и ионы ОН- Н2О = Н+ + ОН-
Н2О = Н+ + ОН-
Основания классифицируют по растворимости в воде и кислотности. К растворимым относятся гидроксиды щелочных и щелочно-земельных металлов (LiОН, NаОН, КОН, КОН, СsОН, Са(ОН)2, Sr(ОН)2, Ва(ОН)2, ТlOН и гидрат аммиака NH4OH). Гидроксиды способны взаимодействовать с кислотными оксидами, а также с кислотами и солями:
2NаОН+Н2SO4 = Nа2SO4+2Н2O
2Nа+ + 2OН- + 2Н+ + SO42- = 2Nа+ + SO42- + 2Н2O
2OН-+2Н+ = 2Н2O
2NаОН + СuSO4=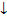 Сu(ОН)2+ Nа2SO4
Сu(ОН)2+ Nа2SO4
2Nа++2OН- + Сu2++SO42- = 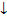 Сu(ОН)2 + 2Nа+ + SO42-
Сu(ОН)2 + 2Nа+ + SO42-
2OН- + Сu2+ = 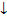 Сu(ОН)2
Сu(ОН)2
|
|
|
|
|
Дата добавления: 2014-10-22; Просмотров: 492; Нарушение авторских прав?; Мы поможем в написании вашей работы!