
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Строение атома и периодический закон Д. И. Менделеева
|
|
|
|
Соли
Соли — это продукты полного или неполного замещения атомов водорода кислоты на атомы металла или гидроксильных групп основания на кислотный остаток.
Основная реакция препаративного получения солей — взаимодействие кислоты и основания. По полноте этой реакции соли делятся на нормальные (или средние), кислые и основные.
К нормальным, или средним, солям относятся продукты полного замещения атомов водорода кислоты на атомы металла или гидроксильных групп основания на кислотный остаток. Например:
Са(ОН)2 + 2HNO3 = Са(NO3)2 + 2Н2О
Са(ОН)2 + 2Н+ + 2NO3- = Са2+ + 2NO3- + 2Н2О
Здесь все (две, а не одна) гидроксильные группы основания Са(ОН)2 замещены на кислотный остаток NO3-
2NaОН + Н2СO3 =Na2СO3 + Н2O
2Na++20Н-+Н2СО3 = 2Na++ +Н2O
+Н2O
Здесь все (два, а не один) атомы водорода кислоты Н2СО3 замещены на атомы металла Na.
Изображение графических формул нормальных солей (как и вообще солей) удобнее начинать с построения кислотного остатка. Например, для силиката бария ВаSiO3 кислотный остаток имеет вид:
 O-
O-
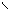 O=Si
O=Si
O-
В отличие от электронейтральной молекулы кислоты он потерял два атома водорода. Этот кислотный остаток обеими своими свободными связами в молекуле ВаSiO3 связан с атомом бария, который имеет степень окисления 2+:

 O
O

 O=Si Ba
O=Si Ba
O
Кислые соли являются продуктом неполного замещения атомов водорода кислоты на металл. Их могут образовывать лишь многоосновные кислоты. В состав кислой соли будет входить кислотный остаток, содержащий хотя бы один атом водорода. Например: Н2SО4 — серная кислота, Na2SО4 — нормальная соль, NаНSО4 — кислая соль. Кислотный остаток. НSО4 - образовался при отщеплении от кислоты одного атома водорода. Если кислота трехосновная, она может образовывать два ряда кислых солей, соответствующих замене на атомы металла одного или двух атомов водорода. Например, фосфорная кислота Н3Р04 может образовывать кислые соли, с различными кислотными остатками:
NаН2РО4 и Nа2НРО4, Са(Н2РО4)2, СаНРО4.
При графическом изображении кислых солей удобно сначала представить кислотный остаток, учитывая, что в него входит незамещенный атом водорода, а затем к свободной валентности присоединить атом металла:
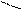 H
H 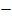 O
O
C=O
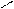 Na
Na 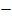 O
O
Основные соли занимают промежуточное положение между основаниями и солями, а значит, содержат, кроме атомов металла и кислотных остатков, гидроксильные группы, связанные с металлом. Они являются продуктом неполного замещения гидроксильных групп гидроксида (двух- и более) кислотным остатком. Например: СаОНС1, СuОНN03 и т. д. В этих солях количество кислотных остатков равно количеству замещенных ОН- — групп, так как это соли одноосновных кислот.
Если гидроксид трехкислотный, то он может образовывать два основных остатка. Например, А1(0Н)3 образует А1(ОН и А1OН2+. Заряды этих ионов равны количеству гидроксильных групп, недостающих до электронейтральной молекулы гидроксида. С любой кислотой в этом случае может образовываться два ряда солей, формулы которых будут зависеть от заряда кислотного остатка. Для HNO3 и Н2СО3 получим: А1(ОН)2NO3 и [А1(0Н)2]2СО3; А1OН(NO3)2 и АlOНСO3.
и А1OН2+. Заряды этих ионов равны количеству гидроксильных групп, недостающих до электронейтральной молекулы гидроксида. С любой кислотой в этом случае может образовываться два ряда солей, формулы которых будут зависеть от заряда кислотного остатка. Для HNO3 и Н2СО3 получим: А1(ОН)2NO3 и [А1(0Н)2]2СО3; А1OН(NO3)2 и АlOНСO3.
При изображении графических формул основных солей надо четко представить, из каких и скольких основных и кислотных остатков состоит данная соль. Например, гидроксо-карбонат кальция имеет формулу (СаОН)2СО3 и состоит из двух основных остатков — Са — О —Н и одного кислотного
 O-
O-
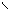 O=C
O=C
O-
Сочетая их вместе, получаем правильную графическую формулу:
 О — Са — О — Н
О — Са — О — Н
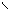 O=C
O=C
О — Са — О — Н
Мы выяснили особенности строения молекул трех основных типов солей. Однокислотное основание может с одноосновной кислотой образовать лишь одну среднюю (нормальную) соль, с двухосновной кислотой — одну среднюю и одну кислую соль, с трехосновной — одну среднюю и две кислых и т. д. Например, в зависимости от взятых соотношений NаОН и Н3РО4, можно получить:
ЗNаОН + Н3РО4 = Nа3РО4 + 3Н2О
2NаОН + Н3РО4 = Nа2НРО4+2Н2О
NаОН + Н3РО4 = NаН2РО4+Н2О
Аналогично, одноосновная кислота может образовать с двухкислотным основанием одну среднюю и одну основную соль, с трехкислотным — одну среднюю и две основные соли и т. д. Пример:
А1(ОН)3 + 3НС1 = А1С13+3Н2О
А1(ОН)3 + 2НС1 = А1OНС12 + 2Н2О
А1(ОН)3 + НС1 = А1(ОН)2С1 + Н2О
Многоосновные кислота и основание могут дать, кроме средней соли, и кислые, и основные. Так, при взаимодействии Са(ОН)2 и Н3РО4 могут быть получены: одна нормальная соль Са3(РО4)2, две кислые соли Са(Н2РО4)2 и СаНРО4, одна основная соль (СаОН)3РО4.
Схема образования названий кислых и основных солей дана в приложении.
Контрольные задания
10. Составьте формулы высших оксидов элементов, являющихся макроэлементами в питании растений, и формулы высших оксидов для микроэлементов. Изобразите их графически. Укажите характер этих оксидов (кислотный, основной, амфотерный). Напишите возможные реакции их взаимодействия с водой.
11-20. Составьте формулы всех солей, соответствующих кислотам и основаниям, приведенным для вашего задания в таблице 2. Написать уравнения реакций их получения из кислоты и основания в молекулярной и ионной форме. Для амфотерных гидроксидов необходимо составлять формулы их солей, образованных как при реакциях с кислотами, так и с основаниями.
При написании уравнений руководствоваться таблицей растворимости и таблицей степеней диссоциации.
Таблица 2
| № задания | Исходные вещества | ||||
| KOH | Zn(OH)2 | HClO4 | H3BO3 | ||
| CsOH | Fe(OH)3 | HClO3 | H2S | ||
| NaOH | Mg(OH)2 | H2SO3 | H3AsO4 | ||
| NH4OH | Cu(OH)2 | H2CO3 | H2SeO4 | ||
| LiOH | Al(OH)3 | HBr | H2TeO4 | ||
| Sr(OH)2 | Fe(OH)3 | HC1 | H2SiO3 | ||
| Ba(OH)2 | Ni(OH)3 | HClO | H2CO3 | ||
| Ca(OH)2 | Co (OH) 3 | HNO2 | H2S2O3 | ||
| Fe(OH)2 | Ca(OH)2 | HNO3 | H3PO4 | ||
| Ca(OH)2 | KOH | HClO3 | H2SO4 | ||
Методические советы
При изучении этого материала следует усвоить современные взгляды на «корпускулярно-волновое состояние» электрона в атоме, вероятностный характер распределения плотности электронного облака и квантование поведения электрона по энергии, формам орбиталей и их положению в пространстве. Поскольку каждый электрон в атоме характеризуется собственным набором квантовых чисел, то они помогают показать распределение электронов в атоме.
Конечным результатом изучения этой темы является умение составить электронную формулу любого атома, выявить его валентность и возможные степени окисления.
Вопросы для самопроверки
- Какие вы знаете элементарные частицы? Укажите их основные характеристики.
- Что такое радиоактивность? Какие виды радиоактивных излучений вам известны?
- Укажите средние размеры атома. Во сколько раз отличаются размеры ядер от размеров атомов?
- Какие квантовые числа характеризуют энергию электрона в атоме в отсутствие внешних электрических и магнитных полей?
- Каков порядок заполнения орбиталей? Сформулируйте правило Гунда. Какова форма з- и р-электронных облаков?
- Какое максимальное количество электронов может размещаться на 1з, 2з, Зз-подуровнях? Чему равен угол между р-орбиталями в атоме?
- Дайте современную формулировку периодического закона Д. И. Менделеева. Как его формулировал сам Д. И. Менделеев?
- Что такое периодичность? В чем причина периодического изменения свойств элементов? Какие главнейшие свойства элементов меняются периодически?
- Каков физический смысл номера периода, номера группы? Дайте определение понятиям группа, период, семейство.
- Что такое потенциал ионизации, сродство к электрону, электроотрицательность?
Контрольные задания
21-30. Составьте электронные формулы и представьте графически размещение электронов по квантовым ячейкам для указанных в табл. 3 элементов, соответствующих вашему заданию. Проанализируйте возможности разъединения спаренных электронов при возбуждении атомов с образованием валентных электронов в соответствии с теорией спин-валентности.
Таблица 3
| № задания | Элементы |
| углерод, скандий | |
| азот, титан | |
| кислород, ванадий | |
| фтор, хром | |
| алюминий, мышьяк | |
| кремний, бром | |
| фосфор, калий | |
| сера, кальций | |
| хлор, бериллий | |
| аргон, железо |
31-40. Проанализируйте изменения величины зарядов ядер, радиусов атомов, электроотрицательностей и степеней окисления элементов в соответствии с вашим вариантом (см. таблицу 4). Каковы закономерности этих изменений при движении по группе сверху вниз или по периоду слева направо? Как изменяется в этом направлении металличность элементов и характер их оксидов и гидроксидов?
Таблица 4
| № задания | Задание |
| элементы 2 периода | |
| элементы 3 периода | |
| элементы 4 периода | |
| элементы 5 периода | |
| элементы 4 B группы | |
| элементы 2 A группы | |
| элементы 4 А группы | |
| элементы 5 А группы | |
| элементы 6 А группы | |
| элементы 7 В группы |
|
|
|
|
|
Дата добавления: 2014-10-22; Просмотров: 932; Нарушение авторских прав?; Мы поможем в написании вашей работы!