
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Концентрация растворов
|
|
|
|
Растворы
Методические советы
Изучение этой темы целесообразно разбить на три этапа. Сначала изучите материал по учебнику и попробуйте ответить на контрольные вопросы 61-70, являющиеся одновременно вопросами для самопроверки. Затем следует выполнить задачи-упражнения на нахождение концентраций растворов (№ 71-80) и после этого разобраться с гидролизом солей в соответствии с настоящими методическими указаниями.
Контрольные задания
61. Какие системы называются растворами? Что у них общего со смесями?
62. Водные растворы и их значение в жизни растений и животных.
63. Каковы причины образования растворов? Какова природа взаимодействия веществ в растворах?
64. Что такое электролитическая диссоциация? Какова роль растворителя в процессе электролитической диссоциации? Какие вещества называются электролитами, неэлектролитами?
65. Что называется степенью электролитической диссоциации? Как зависит степень электролитической диссоциации от концентрации и температуры раствора?
66. Что такое константа диссоциации? От каких факторов она зависит? Какова взаимосвязь между степенью диссоциации и константой диссоциации? Активность и коэффициент активности иона.
67. Какие соединения называются кислотами и основаниями с точки зрения электролитической диссоциации? Чем обусловливается сравнительная сила кислот и оснований?
68. Какие гидроксиды называются амфотерными? Напишите примеры уравнений их диссоциации в кислой и щелочной средах.
69. Что называется ионным произведением воды? Чему оно равно? Дайте вывод выражения ионного произведения воды (Кв). Как влияет температура на ионное произведение воды?
70. Что такое рН, рОН? Какими величинами рН характеризуется нейтральная, кислая и щелочная среда? Как рассчитывать рН растворов сильных и слабых кислот и оснований?
Методические советы
В химических расчетах используется в основном три вида концентрации:
— процентная концентрация показывает, сколько граммов растворенного вещества находится в 100 г раствора,
— молярная концентрация показывает, сколько молей растворенного вещества находится в 1 л (1000 мл) раствора,
— нормальная концентрация показывает, сколько молей эквивалентов растворенного вещества находится в 1 л (1000 мл) раствора.
При решении задач по переходу от одного вида концентрации к другому важно четко разграничить количество растворенного вещества и растворителя, массу и объем и т. д. Контролируется это согласованием единиц измерения в «столбиках» составляемых пропорций.
Количество растворенного вещества выражают в граммах mr, в молях nм, в молях эквивалентов nэ.
Количество раствора выражают в граммах G, в миллилитрах V.
Связь между этими величинами:
nm=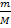 (1)
(1)
nэ=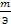 . (2),
. (2),
где М и Э — молекулярная и эквивалентная масса соответственно.
ρ= (3),
(3),
где ρ — плотность раствора.
Задачи на пересчет из одной концентрации в другую являются составным этапом большинства задач, включающих свойства растворов.
Контрольные задания
71-80. В соответствии с номером вашего задания заполните пропуски в таблице 8. Например, в задаче 76 надо найти молярную и нормальную концентрацию 10%-ного раствора СuSO4 (плотность раствора 1,1 г/мл).
Таблица 8
| № задания | Растворенное вещество | Концентрация раствора | |||
| процента. | молярная | нор-мальн. | Плотность раствора | ||
| НNO3 | 1,05 | ||||
| НС1 | 1,2 | 1,02 | |||
| NаОН | 1,05 | ||||
| Н3РO4 | 0,3 | 1,01 | |||
| Н2SO4 | 0,4 | 1,027 | |||
| СuSO4 | принять 1,1 | ||||
| (NH4)2SO4 | 0,1 | принять 1,0 | |||
| КОН | 1,01 | ||||
| СНзСООН | 0,5 | принять1,0 | |||
| КNОз | 0,2 | принять 1,0 |
|
|
|
|
|
Дата добавления: 2014-10-22; Просмотров: 897; Нарушение авторских прав?; Мы поможем в написании вашей работы!