
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кислоты. Амфотерные гидроксиды
|
|
|
|
Амфотерные гидроксиды
Амфотерные гидроксиды занимают промежуточное положение между кислотами и основаниями и проявляют одновременно как свойства кислот, так и свойства оснований.
Характерным признаком амфотерных гидроксидов является их способность взаимодействовать как с кислотами, так и со щелочами с образованием солей:
Ве(ОН)2 + Н2SO4 = ВеSO4 + 2Н2O
Ве(ОН)2 + 2Н+ + SO42- = Ве2+ + SO42- + 2Н2O
Ве(ОН)2 + 2H+ = Ве2+ + 2Н2O
Ве(ОН)2 +2NаОН = Nа2[Ве(ОН)4]
Ве(ОН)2 + 2Nа+ + 2OH- = 2Na+ + [Ве(ОН)4]2-
Ве(ОН)2 + 2OН- = [Ве(ОН)4]2-
Кислоты классифицируют по составу (кислородные и бескислородные), кислотности (одно-, двух-, трехосновные и т. д.), способности к электролитической диссоциации (силе).
При написании графических формул кислородных кислот необходимо определить, степень окисления кислотообразующего элемента по известным степеням окисления кислорода (2-) и водорода (1+). Число валентных штрихов около каждого атома должно отвечать степени его окисления. Ниже приводятся графические формулы некоторых кислот:
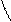 O H
O H O O
O O
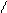
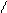
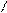
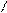
HNO3 H O
O N H2 SO4 S
N H2 SO4 S
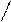
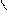
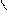
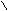
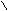
 O H
O H O O
O O
Азотная кислота Серная кислота
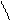
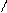 O
O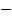 H H
H H 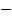 O
O
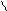 H2S03 O = C
H2S03 O = C
O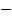 H H3PO4 H
H H3PO4 H 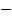 O
O 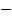 P = O
P = O
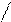
H 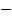 O
O
Угольная кислота Ортофосфорная кислота
O
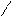
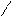 O
O
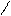
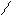 НМnO4 Н
НМnO4 Н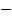 O
O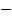 Mn = O
Mn = O
 H
H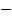 O
O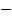 Cr =O
Cr =O
 O
O
H2CrO7 O
 марганцвая кислота
марганцвая кислота
H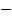 O
O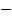 Cr =O
Cr =O
 |
O
Дихромовая кислота
Изучите или вспомните, как образуются названия кислот.
Кислоты взаимодействуют с металлами. Образующиеся при этом продукты различны и зависят от положения металла в ряду напряжения и свойств кислоты. Так, при взаимодействии металлов, стоящих в ряду напряжения до водорода, с кислотами неокислителями образуются соли этих кислот и выделяется водород.
Zn + Н2SO4 = ZnSO4 + Н2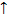
Fе+2НС1 = FеС12+Н2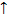
В этих реакциях водород восстанавливается, а цинк и железо окисляются. При взаимодействии металлов с концентрированной или разбавленной азотной, а также с концентрированной серной кислотами происходит восстановление азота (5+) или серы (6+).
Сu + 2Н2 SO4(конц) = СuSO4 + SO2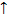 + 2Н2O
+ 2Н2O
Аg +2HNO3(конц) =АgNO3 + NO2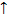 + Н2O
+ Н2O
Кислоты взаимодействуют с основными оксидами, основаниями.
Взаимодействие кислот с солями происходит лишь при протекании необратимых реакций.
Н2SO4 + ВаС12 = ВаSО4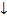 + 2НС1
+ 2НС1
SO42- + Ва2+ = ВаSO4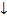
|
|
|
|
|
Дата добавления: 2014-10-22; Просмотров: 640; Нарушение авторских прав?; Мы поможем в написании вашей работы!