
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электролиз. Пример 1. Какая масса меди выделится на катоде при электролизе раствора CuSO4 в течение 1 ч при силе тока 4 А?
|
|
|
|
Пример 1. Какая масса меди выделится на катоде при электролизе раствора CuSO4 в течение 1 ч при силе тока 4 А?
Решение. Согласно законам Фарадея
m=ЭIt/96500. (1)
где т — масса вещества, окисленного или восстановленного на электроде; Э — эквивалентная масса вещества; I - сила тока. А; t - продолжительность электролиза с. Эквивалентная масса меди в CuSO4 равна 63.54:2 = 31.77 г/моль. Подставив в формулу (1) значения Э= 31.77. I=4 А. t = 60 • 60 = 3600 с, получим
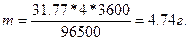
Пример 2. Вычислите эквивалентную массу металла, зная, что при электролизе раствора хлорида этого металла затрачено 3880 Кл электричества и на катоде выделяется 11.742 г металла.
Решение. Из формулы (1)
Э = 11.742 * 96 500/3880 = 29.35 г/моль,
Где m = 11.742 г; It = Q = 3880Кл.
Пример 3. Чему равна сила тока при электролизе раствора в течение 1 ч 40 мин 25 с, если на катоде выделилось 1.4 л водорода (н.у.)
Решение. Из формулы (1)
I=m96500/Эt.
Так как дан объем водорода, то отношение т/Э заменяем отношением VH2/ VЭ(Н2). где VН2 - объем водорода, л; VЭ(Н2) -эквивалентный объем водорода, л. Тогда
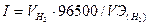
Эквивалентный объем водорода при н.у. равен половине молярного объема 22.4/2 = 11.2 л. Подставив в приведенную формулу значения VН2 = 1.4 л. VЭН2 =11.2л. t =6025 (1 ч 40 мин 25 с = 6025 с). находим
I = 1.4 * 96500/11.2 *6025 =2 А.
Пример 4. Какая масса гидроксида калия образовалась у катода при электролизе раствора КОH, если на аноде выделилось 11.2 л кислорода (н.у.)?
Решение: эквивалентный объем кислорода (н.у.) 22,4/4 = 5,6 л. Следовательно. 11,2 л содержат две эквивалентные массы кислорода. Столько же эквивалентных масс КОН образовалось у катода, или 56.11 *2 = 112,2 г (56.11 г/моль - мольная и эквивалентная масса КОН).
Контрольные вопросы
261. Электролиз раствора K2SO4 проводили при силе тока 5 А в течение 3 ч. Составьте электронные уравнения процессов, происходящих на электродах. Какая масса воды при этом разложилось и чему равен объем газов (н.у.). выделившихся на катоде и аноде? Ответ: 5,03 г; 6.266 л; 3,133 л.
262. При электролизе соли некоторого металла течение 1,5 ч при силе токе 1,8 А на катоде выделилось 1.76 г этого металла. Вычислите эквивалентную массу металла.
263. При электролизе раствора CuSO4 на аноде выделилось 168 см3 газа (н.у.). Составьте электронные уравнения процессов, происходящих на электродах, и вычислить, какая масса меди выделилась на катоде. Ответ: 0.953 г.
264. Электролиз раствора Na2SO4 проводили в течение 5 ч при силе тока 7 А. Составьте электронные уравнения процессов, происходящих на электродах. Какая масса воды при этом разложилась и чему равен объем газов (н.у.), выделившихся на катоде и аноде? Ответ: 11,75 г; 14.62 л; 7.31 л.
265. Электролиз раствора нитрата серебра проводили при сила тока 2 А в течение 4 ч. Составьте электронные уравнения процессов, происходящих на электродах. Какая масса серебра выделилась на катоде и каков объем газа (и.у.). выделившегося на аноде? Ответ: 32.20 г; 1,67л.
266. Электролиз раствора сульфата некоторого металла проводили при силе тока 6 А в течение 45 мин, в результате чего на катоде выделилось 5,49 г металла. Вычислите эквивалентную массу металла. Ответ: 32,7 г/моль.
267. Насколько уменьшится масса серебряного анода, если электролиз раствора AgNO3 проводить при силе тока 2 А в течение 38 мин 20 с? Составьте электронные уравнения процесса. происходящих на графитовых электродах. Ответ: 4,47 г.
268. Электролиз раствора сульфата цинка проводили в течение 5 ч. в результате чего выделилось 6 л кислорода (н.у.). Составьте уравнения электродных процессов и вычислите силу тока. Ответ: 5.74 А.
269. Электролиз раствора CuSO4 проводили с медным анодом в течение 4 ч при силе тока 50 А. При этом выделилось 224 г меди. Вычислите выход по току (отношение массы выделившегося вещества к теоретически возможной). Составьте электронные уравнения процессов, происходящих на электродах в случае медного и угольного анода. Ответ: 94.48%.
270. Электролиз раствора NaI проводили при силе тока 6 А в течение 2.5 ч. Составьте электронные уравнения процессов, происходящих на угольных электродах, и вычислите массу вещества, выделившегося на катоде и аноде? Ответ: 0,56 г; 71.0 г.
271. Составьте электронные уравнения процессов, происходящих на угольных электродах при электролизе раствора AgNO3. Если электролиз проводить с серебряным анодом, то его масса уменьшается на 5,4 г. Определите расход электричества при этом. Ответ: 4830 Кл.
272. Электролиз раствора CuSO4 проводили в течение 15 мин при силе тока 2,5 А. Выделилось 0,72 г меди. Составьте электронные уравнения процессов, происходящих на электродах в- случае медного и угольного анода. Вычислить выход по току (отношение массы выделившегося вещества- к теоретически возможной). Ответ: 97,3%.
273. Составьте электронные уравнения процессов, происходящих на графитовых электродах при электролизе расплавов водных растворов NaC1 и КОН. Сколько литров (н.у.) газа выделится на аноде при электролизе гидроксида калия, если электролиз проводить в течение 30 мин при сила тока 0,5 А? Ответ: 0.052 л.
274. Составьте электронные уравнения процессов, происходящих ив графитовых электродах при электролизе раствора КВr. Какая масса вещества выделяется на катоде и анода, если электролиз проводить в течение 1 ч 35 мин при силе токе 15 А? Ответ: 0.886г, 70,79г.
275. Составьте электронные уравнения процессов, происходящих на угольных электродах при электролизе раствора СuCl2. Вычислите массу меди, выделившуюся на катоде если на аноде выделилось 560 мл газа (н.у.). Ответ: 1,588 г.
276. При электролизе соли трехвалентного металла при силе тока 1,5 А в течение 30 мин на катоде выделилось 1.071 г металла. Вычислите атомную массу металла. Ответ: 114,82
277. При электролизе растворов MgSO4 и ZnС12,соединвнных последовательно с источником тока, на одном из катодов выделилось 0,25 г водорода. Какая масса вещества выделится на другом катоде; на анодах? Ответ: 8,17 г; 2,0 г; 8,86 г.
278. Составьте электронные уравнения процессов, происходящих на угольных электродах при электролизе растворе Na2SO4. Вычислите массу вещества, выделяющегося на катоде, если на аноде выделяется 1,12 л газа (н.у.). Какая масса H2SO4 образуется при этом возле анода? Ответ: 0.2 г; 9,8 г.
279. При электролизе раствора соли кадмия израсходовано 3434 Кл электричества. Выделилось 2 г кадмия. Чему равна эквивалентная масса кадмия? Ответ: 56.26 г/моль.
280. Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора КОН. Чему равна сила тока, если в течение 1 ч 15 мин 20 с на аноде выделилось 6.4 г газа? Сколько литров газа (н.у.) выделилось при этом на катоде? Ответ: 17,08 А; 8,96 л.
|
|
|
|
|
Дата добавления: 2014-10-23; Просмотров: 13902; Нарушение авторских прав?; Мы поможем в написании вашей работы!