
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Комплексные соединения
|
|
|
|
Комплексообразование происходит во всех случаях, когда из менее сложных систем образуются системы более сложные.
В структуре комплексного соединения различают координационную (внутреннюю) сферу, состоящую из центральной частицы - комплексообразователя (ион или атом) - и окружающих ее лигандов (ионы противоположного знака или молекулы). Ионы, находящиеся за пределами координационной сферы образуют внешнюю сферу комплексного соединения. Число лигандов вокруг комплексообразователя называют его координационным числом. Внутренняя сфера (комплекс) может быть анионом, катионом и не иметь заряда. Например, в комплексном соединении K3[Fe(CN)6] внешняя сфера -3К+, внутренняя сфера [Fe(CN)6]3-- где Fe3+ - комплексообразователь, a 6CN- - лиганды, причем 6 - координационное число. Таким -образом комплексное соединение (как правило) в узлах кристаллическойрешетки, содержит комплекс, способный к самостоятельному существованию и в растворе.
Пример 1. Определите заряд комплексного иона, координационное число (к.ч.) и степень окисления комплексообразователя в соединениях: а) К4[Fe(CN)6]; б) Na[Ag(N02)2]; в) K2[MoF8]; г)[Cr(H2O)2(NH3)3Сl]С12.
Решение: Заряд комплексного иона равен заряду внешней сферы, но противоположен ему по знаку. Координационное число комплексообразователя равно числу лигандов, координированных вокруг него. Степень окисления комплексообразователя
определяется так же, как степень окисления атома в любом соединении, исходя из того, что сумма степеней окисления всех атомов в молекуле равна нулю. Заряды нейтральных молекул (Н2О) равны нулю. Заряды кислотных остатков определяются из формул соответствующих кислот. Отсюда:
| Заряды иона | к. ч. | Степень окисления | |
| а) | -4 | +2 | |
| б) | -1 | +1 | |
| в) | -2 | +6 | |
| г) | +2 | +3 |
Пример 2. Напишите выражение для константы нестойкости комплекса [Fe(CN)6]4-.
Решение. Если комплексная соль гексацианоферрат (II) калия, являясь сильным электролитом, в водном растворе необратимо диссоциирует на ионы внешней и внутренней сфер.
К4[Fe(CN)6]=4K++[Fe(CN)6)4-
то комплексный ион диссоциирует обратимо в незначительной степени на составляющие его частицы;
[Fe(CN)6]4-↔Fe2++6CN-
Обратимый процесс характеризуется своей константой равновесия, которая в данном случае называется константой нестойкости (КН) комплекса:
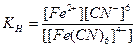
Чем меньше значение КН тем более прочен данный комплекс.
Контрольные вопросы
301. Определите, чему равны заряд комплексного иона, степень окисления и координационное число комплексообразователя в соединениях [Cu(NH3)4]SO4, K2[PtCl5], K[Ag(CN)2]. Напишите уравнения диссоциации этих соединений в водных растворах.
302. Составьте координационные формулы следующих комплексных соединений платины: PtCl4 • 6NH3, PtCl4 • 4NH3, PtCI4 • 2NH3. Координационное число платины (IV) равно шести. Напишите уравнение диссоциации этих соединений в водных растворах. Какое из соединений является комплексным неэлектролитом?
303. Состав координационные формулы следующих комплексных соединений кобальта: СоCl3 • 6NH3 • СоCl3 • 5NH3 • СоCl3 • 4NН3. Координационное число кобальта (III) равно шести. Напишите уравнения диссоциации этих соединений в водных растворах.
304. Определите, чему равны заряд комплексного иона, степень окисления и координационное число сурьмы в соединениях Rb[SbBr6], K[SbC16], Na[Sb(SO4)2]. Как диссоциируют эти соединения в водных растворах?
305. Составьте координационные формулы следующих комплексных соединений серебра: AgCl • 2NH3 • AgCN • KCN, AgNO2 • NaNO2. Координационное число серебра равно двум. Напишите уравнения диссоциации этих соединений в водных растворах.
306. Определите, чему равны заряд комплексного иона степень окисления и
координационное число комплексообразователя в соединениях K4[Fe(CN)6], K4[TiCl8], K2[HgI4]? Как дисоциируют в водных растворах?
307. Из сочетания частиц Со3+, NH3, NO2- и К+ можно составить семь координационных формул комплексных соединений кобальта, одна из которых [Cо(NH3)6](NO2)3. Составьте формулы других шести соединений и напишите уравнения их диссоциации в водных растворах.
308. Определите, чему равен заряд следующих комплексных ионов: [Сr(Н2О)4Сl2],[НgBr4], [Fe(CN)6], если комплексообразователями являются Сг3+. Нg2+, Fe3+. Напишите формулы комплексных соединений содержащих эти ионы.
309. Определите, чему равен заряд комплексных ионов [Cr(NH3)5NO3], [Рd(NH3)Cl3] [Ni(CN)4], если комплексообразователями являются Cr3+. Pd2+, Ni2+. Напишите формулы комплексных соединений, содержащих эти ионы.
310. Из сочетания частиц Сг3+, Н2O, Сl- и K+ можно составить семь координационных Формул комплексных соединений хрома, одна из которых [Сr(Н2О)6]С13. Составьте формулы других шести соединение и напишите уравнения их диссоциации в водных растворах.
311. Составьте координационные формулы следующих комплексных соединений кобальта: 3NaNO2 • Со(NO2)3, СоС13 • ЗNН3 • 2Н2О, 2КNO2 • NH3 • Co(NO2)3 Координационное число кобальта равно шести. Напишите уравнения диссоциации этих соединений в водных растворах.
312. Напишите выражение, для констант нестойкости комплексных ионов [Ag(NH3)2]+, [Fe(CN)6]4-, [PtCl6]2-. Чему равны степень окисления и кoординационное число комплексообразователей в этих ионах?
313. Константы нестойкости комплексных ионов [Co(CN)4]2-,[Hg(CN)4]2-, [Cd(CN)4]2- соответственно равны 8*10-20. 4* 10-41, 1.4*10-17. В каком растворе, содержащем эти ионы, при равной молярной концентрации ионов CN- больше? Напишите выражения для констант нестойкости казенных комплексных ионов.
314. Напишишите выражения для констант нестойкости следующих комплексных ионов:[Ag(CN)2]-,[Ag(NH3)2]+, [Ag(SCN)2]-. Зная, что они соответственно равны 1.0*10-21, 6,8*10-8, 2,0 • 10-11, укажите, в каком растворе, содержащем эти ионы, при равной молярной концентрации больше ионов Аg+.
315. При прибавлении раствора KCN к раствору [Zn(NH)3]4SO4 образуется растворимое комплексное соединение К2[Zn(CN)4]. Напишите молекулярное и ионно-молекулярное уравнение реакции. Константа нестойкости какого иона, [ Zn(NH3)4]2+ или, [Zn(CN)4]2- больше? Почему?
316. Напишите уравнения диссоциации солей K3[Fe(CN)6] и NH4Fe(SO4)2 в водном растворе. К каждой из них прилили раствор щелочи. В каком случае выпадает осадок гидроксида железа (III)? Напишите молекулярное и ионно-молекулярное уравнения реакции. Какие комплексные соединения называются двойными солями?
317. Составьте координационные формулы следующих комплексных соединений платины (II), координационное число которой равно четырем: PtCl2 • 3NH3, PtCl2 • NH3 • КCl, PtCl2 • 2NH3. Напишите уравнения диссоциации этих соединений в водных растворах. Какое из соединений является комплексным неэлектролитом?
318. Хлорид серебра растворяется в растворах аммиака и тиосульфата натрия. Дайте этому объяснение и напишите молекулярные и ионно-молекулярные уравнения соответствующих реакций.
319. Какие комплексные соединения называются данными солями? Напишите уравнения диссоциации солей K4[Fe(CN)6] и (NH4)2Fe(SO4)2 в водном растворе. В каком случае выпадает осадок гидроксида железа (II) если к каждой из них прилить раствор щелочи? Напишите молекулярное и ионно-молекулярное уравнения реакций.
320. Константы нестойкости комплексных ионов [Co(NH3)6]3+, [Fe(CN)6]4-, [Fe(CN)6]3- соответственно равны 6.2* 10-36. 1.0*10-37, 1,0*10-44. Какой из этих ионов является более прочным? Напишите выражения для констант нестойкости указывая комплекс ионов и формулы соединений, содержащих эти ионы.
S - Элементы (ns1-2)
Контрольные вопросы
321. Какую степень окисления может проявлять водород в своих соединениях? Приведите примеры реакций, в которых газообразный водород играет роль окислителя и в которых - восстановителя.
322. Напишите уравнения реакций натрия с водородом, кислородом, азотом и серой. Какую степень окисления приобретают атомы окислителя в каждой из этих реакций?
323. Напишите уравнения реакций с водой следующих соединений натрия: Na2O2. Na2S, NaH, Na3N.
324. Как получают металлический натрий? Составьте электронные уравнения процессов, проходящих на электродах при электролизе расплава NaOH.
325. Какие свойства может проявлять пероксид водорода в окислительно-восстановительных реакциях? Почему? На основании электронных уравнений напишите уравнения реакций Н2О2: а) с Аg2О; б) с KI.
326. Почему пероксид водорода способен диспропорционировать (самоокисляться - самовосстанавливаться)? Составьте электронные и молекулярные уравнения процесса разложения Н2О2.
327. Как можно получить гидрид и нитрид кальция? Напишите уравнения реакций этих соединений с водой. К окислительно-восстановительным реакциям составьте электронные уравнения.
328. Назовите три изотопа водорода. Укажите состав их ядер. Что такое тяжелая вода? Как она получается и каковы ее свойства?
329. Гидроксид, какого из s - элементов проявляет амфотерные свойства? Составьте молекулярные и ионно-молекулярные уравнения реакций этого гидроксида: а) с кислотой, б) со щелочью.
330. При пропускании диоксида углерода через известковую воду раствор Са (ОН)2 образуется осадок, который при дальнейшем пропускании СО2 растворяется. Дайте объяснение этому явлению. Составьте уравнения реакций.
331. Составьте электронные и молекулярные - уравнения реакций: а) бериллия с раствором щелочи; б) магния с концентрированной серной кислотой, учитывая, что окислитель приобретает низшую степень окисления.
332. При сплавлении, оксид бериллия взаимодействует с диоксидом кремния и с оксидом натрия. Напишите уравнения соответствующих реакций. О каких свойствах ВеО говорят эти реакции?
333. Какие соединения магния и кальция применяются в качестве вяжущих строительных материалов? Чем обусловлены их вяжущие свойства?
334. Как можно получить карбид кальция? Что образуется при его взаимодействии с водой? Напишите уравнения соответствующих реакций.
335. Как можно получить гидроксиды щелочных металлов? Почему едкие щелочи необходимо хранить в хорошо закрытой посуде? Составьте уравнения реакций, происходящих при насыщении гидроксида натрия в) хлором; б) оксидом серы SO3; в) сероводородом.
336. Чем можно объяснить большую восстановительную способность щелочных металлов. При сплавлении гидроксида натрия с металлическим натрием последний восстанавливает водород щелочи в гидрид-ион. Составьте электронные и молекулярные уравнения этой реакции.
337. Какое свойство кальция позволяет применять его в металлотермии для получения некоторых металлов из соединений? Составите электронные и молекулярные уравнения реакции кальция: а) с V2O5 б) CaSO4. В каждой из этих реакций окислитель восстанавливается максимально, приобретая низшую степень окисления.
338. Какие соединения называют негашеной и гашеной известью? Составьте уравнения реакций их получения. Какое соединение образуется при прокаливании негашеной извести с углем? Что является окислителем и восстановителем в последней реакции? Составьте электронные и молекулярные уравнения.
339. Составьте электронные и молекулярные уравнения реакций: а) кальция с водой; б) магния с азотной кислотой, учитывая, что окислитель приобретает низшую степень окисления.
340. Составьте уравнения реакций, которые нужно провести для осуществления следующих превращений:
Ca→CaH2→Ca(OH)2→CaCO3→Ca(HCO3)2
|
|
|
|
|
Дата добавления: 2014-10-23; Просмотров: 2275; Нарушение авторских прав?; Мы поможем в написании вашей работы!