
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
S: Температурный коэффициент скорости реакции, если при повышении температуры на 30о скорость реакции увеличилась в 64 раз, равен
|
|
|
|
-: 8;
-: 4;
-: 2;
+: 4.
I: {{43}}
S: Выражение для константы равновесия реакции 2NO (г) + O2 (г) ↔ 2NO2(г)
+: Кр = [NO2]²/[NO]²[O2];
-: Кр = [NO2]/[NO];
-: Кр = 1/[NO2];
-: Кр = [NO]/[NO2].
I: {{44}}
S: Реакция, для которой повышение давления вызовет смещение равновесия вправо
-: 2NF3(г) + 3H2(г) ↔ 6HF(г) + N2(г);
-: CH4(г) + 4S(т) ↔ CS2(г) + 2H2S(г);
+: 2NO(г) + Cℓ2(г) ↔ 2NOCℓ(г);
-: 2O3(г) ↔3O2(г).
I: {{45}}
S: Тело или группа тел, или совокупность веществ, находящихся во взаимодействии и обособленных от окружающей их внешней среды, называется ###
+: систем#$#
I: {{46}}
S: Изменение энтальпии в процессе образования данного вещества в стандартном состоянии из термодинамически устойчивых форм простых веществ, также находящихся в стандартных состояниях, называется
-: энергией Гиббса;
+: стандартной энтальпией;
-: стандартной энтропией;
-: изобарно-изотермическим потенциалом.
I: {{47}}
S: Совокупность стадий, из которых складывается химическая реакция, называется
+: механизм;
-: скорость;
-: путь процесса;
-: порядок.
I: {{48}}
S: Установите соответствие между путём процесса и характеризующим его параметром
L1: изобарно-изотермический
L2: изохорно-изотермический
L3:
L4:
R1: давление и температура
R2: объём и температура
R3: отсутствует обмен теплотой между системой и внешней средой
R4: присутствует обмен теплотой
I: {{49}}
S: Установите соответствие между путём процесса и характеризующим его параметром
L1: изохорно-изотермический
L2: адиабатный
L3:
L4:
R1: объём и температура
R2: отсутствует обмен теплотой между системой и внешней средой
R3: давление и температура
R4: присутствует обмен теплотой
I: {{50}}
S: Установите соответствие между путём процесса и характеризующим его параметром
L1: изобарно-изотермический
L2: адиабатный
L3:
L4:
R1: давление и температура
R2: отсутствует обмен теплотой между системой и внешней средой
R3: объём и температура
R4: присутствует обмен теплотой
I: {{51}}
S: Равновесие реакции C2Н4(г) + Н2O(г) ↔ C2Н5OН(г), ΔHо < 0 при увеличении давления сместится
-: в сторону исходных веществ;
-: не изменится;
-: неоднозначно;
+: в сторону конечного продукта.
I: {{52}}
S: Энтальпия образования жидкой воды, если при взаимодействии 1 моль водорода и 0,5 моль кислорода выделилось 285,83 кДж тепла, равна
+: –285,83 кДж/моль;
-: +142,9 кДж/моль;
-: –142,9 кДж/моль;
-: +285,83 кДж/моль.
I: {{53}}
S: Изменение энергия Гиббса (DGо) реакции
NH3(г) + HCℓ(г) = NH4Cℓ(кр); ΔHо= –175,97 кДж
(Sо(NH4Cℓкр) = 95,81 Дж/моль×K; Sо(NH3(г)) = 192,66 Дж/моль×K;
Sо(HCℓ(г)) = 186,79 Дж/моль×K) равно
-: +75,97 кДж;
-: –87,9 кДж;
-: +87,9 кДж;
+: –91,45 кДж.
I: {{54}}
S: Скорость прямой реакции CO2(г) + 2SO2(г) ↔ CS2(г) + 3O2(г) при понижении давления в 3 раза уменьшится
-: в 3 раза;
-: в 6 раз;
-: в 9 раз;
+: в 27 раз.
I: {{55}}
S: Температуру газообразной смеси следует повысить на ### град для увеличения скорости реакции в 81 раз (γ = 3)
-: 20;
-: 30;
+: 40;
-: 50.
I: {{56}}
56. Выражение константы равновесия реакции 2SO 2(г) + O2 (г) ↔ 2SO3(г)
+: Кр = [SO3]²/[SO2]²[O2];
-: Кр = [SO3]/[SO2];
-: Кр = 1/[SO2];
-: Кр = [SO2]/[SO3].
I: {{57}}
S: Равновесие реакции CO2(г) + MgO(кр) ↔ MgCO3(кр), ΔHо < 0 сместится влево при
-: повышении давления;
-: повышении концентрации CO2;
-: введении MgCO3;
+: повышении температуры.
I: {{58}}
S: Количество тепла (кДж), которое необходимо затратить для образования
10 моль кислорода по реакции KCℓO4(тв) = KCℓ(тв) + 2O2(г), ΔHо = +33 кДж
+: +165;
-: +33;
-: +66;
-: +330.
I: {{59}}
S: Объём (дм3) газа, который выделится при разложении СаСО3, если при этом поглотилось 178,2 кДж тепла (ΔHо(СаСО3) = -1206,8 кДж/моль,
ΔHо(СаО) = -635,1 кДж/моль, ΔHо(СО2) = -393,5 кДж/моль), равен
+: 22,4;
-: 11,2;
-: 16,8;
-: 5,6.
I: {{60}}
S: Равновесие в системе С2Н2(г) + Н2О(г) ↔ С2Н5ОН(г) , ΔHо < 0 при уменьшении температуры
-: сместится в сторону исходных веществ;
-: изменится неоднозначно;
+: сместится в сторону продуктов реакции;
-: не изменится.
I: {{61}}
S: Равновесие смещается при понижении температуры в сторону ### реакции
-: эндотермической;
+: экзотермической;
-: адиабатической;
-: изотермической.
I: {{62}}
S: Равновесие смещается при повышении давления в сторону
+: меньшего объёма системы;
-: большего объёма системы;
-: экзотермической реакции;
-: эндотермической реакции.
I: {{63}}
S: Равновесие смещается при понижении температуры в сторону ### реакции
-: эндотермической;
+: экзотермической;
-: адиабатической;
-: изотермической.
I: {{64}}
S: Равновесие смещается при понижении давления в сторону
-: меньшего объёма системы;
+: большего объёма системы;
-: экзотермической реакции;
-: эндотермической реакции.
I: {{65}}
S: Количество тепла (кДж), которое необходимо затратить для получения оксида кальция массой 112 г по реакции
СаСО3(тв) = СаО(тв) + СO2(г), ΔHо = +178,2 кДж
(ΔHо(СаСО3) = -1206,8 кДж/моль, ΔHо(СаО) = -635,1 кДж/моль,
ΔHо(СО2) = -393,5 кДж/моль)
+: +356,4;
-: -178,2;
-: +89,1;
-: -534,6.
I: {{66}}
S: Все, что окружает систему, называется
+: внешней средой;
-: внутренней средой;
-: компонентом;
-: фазой.
I: {{67}}
S: Процесс, протекающий с выделением теплоты, называется
+: экзотермическим;
-: эндотермическим;
-: адиабатным;
-: изотермическим.
I: {{68}}
S: Количество вещества, вступающего в реакцию или образующегося в результате реакции в единицу времени на единицу объёма (для гомогенной системы) или на единицу поверхности раздела фаз (для гетерогенной системы), называется
+: скоростью химической реакции;
-: порядком химической реакции;
-: механизмом химической реакции;
-: концентрацией.
I: {{69}}
S: Процесс, протекающий в системе при постоянной температуре, называется
-: экзотермическим;
-: эндотермическим;
-: адиабатическим;
+: изотермическим.
I: {{70}}
S: Процесс, протекающий в системе при постоянной энергии, называется
-: экзотермическим;
-: эндотермическим;
+: адиабатическим;
-: изотермическим.
I: {{71}}
S: Процесс, протекающий в системе при постоянном объёме, называется
-: экзотермическим;
-: эндотермическим;
+: изохорическим;
-: изотермическим.
I: {{72}}
S: Процесс, протекающий в системе при постоянном давлении, называется
-: экзотермическим;
-: эндотермическим;
+: изобарическим;
-: изотермическим.
I: {{73}}
S: Химическая реакция, протекающая через несколько промежуточных стадий, называется
+: сложной;
-: простой;
+: многостадийной;
-: промежуточной.
I: {{74}}
S: Химическая реакция, протекающая в одну стадию, называется
-: сложной;
+: простой;
-: многостадийной;
-: промежуточной.
I: {{75}}
S: Энтальпия образования хлороводорода, если при взаимодействии 1 моль водорода и 1 моль хлора выделилось 184 кДж тепла, равна
+: –92 кДж/моль;
-: +92 кДж/моль;
-: –184 кДж/моль;
-: +184 кДж/моль.
I: {{76}}
S: Температура, при которой наступит равновесие в системе, равна
PCℓ5(г) ↔ PCℓ3(г) + Cℓ2(г); ΔHо = 92,59 кДж
(Sо(Cℓ2) = 222,98 Дж/моль×K; Sо(PCℓ5) = 364,47 Дж/моль×K;
Sо(PCℓ3) = 311,71 Дж/моль×K)
-: 688,3 K;
+: 543,9 K;
-: 888,5 K;
-: 900,0 K.
I: {{77}}
S: Скорость прямой реакции Н2(г) + Br2(г) ↔ 2HBr(г) при повышении давления в три раза возрастет
+: в 9 раз;
-: в 12 раз;
-: в 6 раз;
-: в 3 раза.
I: {{78}}
S: Температурный коэффициент скорости реакции, если при понижении температуры на 30о скорость реакции уменьшилась в 27 раз, равен
-: 8;
-: 4;
-: 2;
+: 3.
I: {{79}}
S: Выражение константы равновесия реакции CO (г) + Cℓ2 (г) ↔ COCℓ2(г)
+: Кр = [COCℓ2]/[CO][Cℓ2];
-: Кр = [CO]/[Cℓ2];
-: Кр = 1/[COCℓ2];
-: Кр = [CO]/[COCℓ2].
I: {{80}}
S: Реакция, для которой изменение объёма системы не вызовет смещения равновесия
-: 2SO2(г) + O2(г) ↔ 2SO3(г);
-: N2O4(г) ↔ 2NO2(г);
+: H2(г) + Сℓ2(г) ↔ 2HCℓ(г);
-: N2(г) + 3H2(г) ↔ 2NH3(г).
I: {{81}}
S: Система, внутри которой нет поверхностей раздела, отделяющих друг от друга части системы, различающиеся по свойствам, называется ###
+: гомогенн#$#
I: {{82}}
S: Процесс, идущий с поглощением теплоты, называется
+: эндотермическим;
-: экзотермическим;
-: изохорическим;
-: изотермическим.
I: {{83}}
S: Изменение концентрации реагирующих веществ в единицу времени в единице объёма или число элементарных актов взаимодействия в единицу времени в единице объёма, называется
+: скоростью химической реакции;
-: порядком химической реакции;
-: механизмом химической реакции;
-: концентрацией.
I: {{84}}
S: Установите соответствие между названием закона и его математическим выражением
L1: действия масс
L2: Гесса
L3:
L4:
R1: υ = k [A]a[B]b
R2: ΔНо = åΔ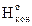 – åΔ
– åΔ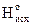
R3: υt2 = υt1gt2 – t1/10
R4: Росм = сRT
I: {{85}}
S: Установите соответствие между названием правила или закона и его математическим выражением
L1: закон Гесса
L2: правило Вант-Гоффа
L3:
L4:
R1: ΔНо = åΔ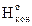 – åΔ
– åΔ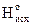
R2: υt2 = υt1gt2 – t1/10
R3: υ = k [A]a[B]b
R4: Росм = сRT
I: {{86}}
S: Установите соответствие между названием правила или закона и его математическим выражением
L1: закон действия масс
L2: правило Вант-Гоффа
L3:
L4:
R1: υ = k [A]a[B]b;
R2: υt2 = υt1gt2 – t1/10;
R3: DНо = å∆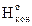 – åD
– åD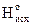
R4: Росм = сRT
I: {{87}}
S: Энтальпия образования оксида азота(II), если при взаимодействии
1 моль азота и 1 моль кислорода поглотилось 182,52 кДж тепла, равна
-: –182,52 кДж/моль;
-: –91,26 кДж/моль;
+: +91,26 кДж/моль;
-: +182,52 кДж/моль.
I: {{88}}
S: Температура, при которой наступит равновесие в системе
2НCℓ(г) ↔ Н2(г) + Cℓ2(г); DHо = –184,62 кДж
(Sо(Cℓ2) = 222,98 Дж/моль×K; Sо(Н2) = 130,52 Дж/моль×K;
Sо(НCℓ) = 186,79 Дж/моль×K), равна
-: 6883 K;
-: 5439 K;
-: 8885 K;
+: 9231 K.
I: {{89}}
S: Скорость прямой реакции CO2(г) +C(графит) ↔ 2CO(г) при повышении давления в 4 раза возрастет
+: в 4 раза;
-: в 8 раз;
-: в 16 раз;
-: в 32 раза.
I: {{90}}
S: Температурный коэффициент скорости реакции, если при повышении температуры на 50o скорость реакции увеличилась в 32 раза, равен
-: 5;
-: 4;
+: 2;
-: 3.
I: {{91}}
S: Константа равновесия реакции 4HCℓ(г) + O2(г) ↔ 2H2O(г) + 2Сℓ2(г) равна ###, если равновесные концентрации (моль/дм3) равны: [Cℓ2] = 0,04; [H2O] = 0,016; [HCℓ] = 0,08; [O2] = 0,1
+: 0,1;
-: 0,04;
-: 0,2;
-: 0,3.
I: {{92}}
S: Набор реакций, в которых увеличение объёма системы не вызовет смещения равновесия
-: 2SO2(г) + O2(г) ↔ 2SO3(г) и H2(г) + Сℓ2(г) ↔ 2HCℓ(г);
-: N2O4(г) ↔ 2NO2(г) и N2(г) + 3H2(г) ↔ 2NH3(г);
-: PCℓ5(г) ↔ PCℓ3(г) + Cℓ2(г) и 2CO(г) +O2(г) ↔ 2CO2(г);
+: H2(г) + J2(г) ↔ 2HJ(г) и N2(г) + O2(г) ↔ 2NO(г).
I: {{93}}
S: Системы, в которых существуют поверхности раздела, отделяющие друг от друга части системы, различающиеся по свойствам, называются
+: гетерогенными;
-: гомогенными;
-: однофазными;
-: однородными.
I: {{94}}
S: Процесс перехода от одного равновесного состояния к другому равновесию называется
+: смещение химического равновесия;
-: путем процесса;
-: скоростью химической реакции;
-: механизмом химической реакции.
I: {{95}}
S: Невозможен процесс, единственным результатом которого было бы превращение теплоты в работу
+: второй закон термодинамики;
-: первый закон термодинамики;
-: третий закон термодинамики;
-: нулевой закон термодинамики.
I: {{96}}
S: Установить соответствие между законами термодинамики и их формулировкой
L1: первый
L2: второй
L3:
L4:
R1: вечный двигатель первого рода невозможен
R2: теплота не может переходить сама собой от менее нагретого тела к более нагретому
R3: энтропия правильно сформированного кристалла чистого вещества при абсолютном нуле равна нулю
R4: если две термодинамические системы находятся в термодинамическом равновесии с третьей системой, то они находятся в термодинамическом равновесии между собой
I: {{97}}
S: Установить соответствие между законами термодинамики и их формулировкой
L1: первый
L2: третий
L3:
L4:
R1: вечный двигатель первого рода невозможен
R2: энтропия правильно сформированного кристалла чистого вещества при абсолютном нуле равна нулю
R3: теплота не может переходить сама собой от менее нагретого тела к более нагретому
R4: если две термодинамические системы находятся в термодинамическом равновесии с третьей системой, то они находятся в термодинамическом равновесии между собой
I: {{98}}
S: Установить соответствие между законами термодинамики и их формулировкой
L1: второй
L2: третий
L3:
L4:
R1: теплота не может переходить сама собой от менее нагретого тела к более нагретому
R2: энтропия правильно сформированного кристалла чистого вещества при абсолютном нуле равна нулю
R3: вечный двигатель первого рода невозможен
R4: если две термодинамические системы находятся в термодинамическом равновесии с третьей системой, то они находятся в термодинамическом равновесии между собой
I: {{99}}
S: Установить соответствие между законами термодинамики и их формулировкой
L1: нулевой
L2: второй
L3:
L4:
R1: если две термодинамические системы находятся в термодинамическом равновесии с третьей системой, то они находятся в термодинамическом равновесии между собой
R2: теплота не может переходить сама собой от менее нагретого тела к более нагретому
R3: энтропия правильно сформированного кристалла чистого вещества при абсолютном нуле равна нулю
R4: вечный двигатель первого рода невозможен
I: {{100}}
S: Энтальпия образования (кДж/моль) карбоната кальция равна, если при его разложении поглощается 178,2 кдж тепла (ΔHо(СаO) = –601,5 кДж/моль, ΔHо(СО2) = –393,5 кДж/моль) (запишите число с точностью до десятых долей) ###
+: –1206*8
I: {{101}}
S: Температура (К), при которой наступит равновесие в системе
CO2(г) + 2SO2(г) ↔ CS2(г) + 3O2(г); ΔHо= 1104 кДж
(Sо(CO2) = 213,66 Дж/моль×K; Sо(SO2) = 248,07 Дж/моль×K;
Sо(CS2) = 237,77 Дж/моль×K; Sо(O2) = 205,04 Дж/моль×K), равна
(запишите число с точностью до целых) ###
+: 7715
I: {{102}}
S: Скорость прямой реакции Н2(г) + J2(г) ↔ 2HJ(г) при повышении давления в 5 раз возрастет
-: в 5 раз;
-: в 10 раз;
+: в 25 раз;
-: в 125 раз.
I: {{103}}
S: Температурный коэффициент скорости реакции равен ###, если при повышении температуры на 60j скорость реакции увеличилась в 64 раза
-: 5;
-: 4;
+: 2;
-: 3.
I: {{104}}
S: Константа равновесия для реакции 2NO + O2 ↔ 2NO2 , если в состоянии равновесия концентрации веществ были (моль/дм3): [NO] = 0,56; [O2] = 0,28; [NO2] = 0,44, равна
+: 2,2;
-: 5,6;
-: 2,8;
-: 4,4.
I: {{105}}
S: Реакция, в которой увеличение объёма системы не вызовет смещения равновесия
-: PCℓ5(г) ↔ PCℓ3(г) + Cℓ2(г) ;
+: H2(г) + J2(г) ↔ 2HJ(г);
-: 2CO(г) +O2(г) ↔ 2CO2(г);
-: 2NО(г) + O2(г) ↔ 2NO2 (г).
I: {{106}}
S: Равновесие реакции CO2(г) + CaO(кр) ↔ CaCO3(кр), ΔHо < 0 сместится вправо при
+: повышении давления;
+: повышении концентрации CO2;
-: дополнительном введении CaCO3;
-: повышении температуры.
I: {{107}}
S: Термическая устойчивость в ряду соединений ZnO → CdO → HgO
(ΔHо(ZnO) = –350,6 кДж/моль; ΔHо(CdO) = -260,0 кДж/моль;
ΔHо(HgO) = +90,9 кДж/моль)
-: не изменяется;
+: убывает;
-: изменяется периодически;
-: возрастает.
I: {{108}}
S: Абсолютная энтропия в ряду соединений HF → HCℓ → HBr
-: не изменяется;
-: убывает;
-: изменяется периодически;
+: возрастает.
I: {{109}}
S: Система, которая обменивается с внешней средой и энергией, и веществом, называется ###
+: открыт#$#
I: {{110}}
S: Для увеличения выхода продуктов реакции
2Pb(NO3)2(тв) → 2PbO(тв) + 4NO2(г) + O2(г), ΔHо > 0 необходимо
-: увеличить концентрацию Pb(NO3)2(тв);
+: уменьшить давление;
-: уменьшить температуру;
-: ввести катализатор.
I: {{111}}
S: Равновесие при увеличении концентрации исходных веществ смещается
+: в сторону конечных продуктов;
-: в сторону экзотермической реакции;
-: в сторону увеличения объёма системы;
-: в сторону уменьшения объёма системы.
I: {{112}}
S: Стандартная энтропия в ряду соединений СuO → Cu2O → CO → CO2
-: не изменяется;
-: убывает;
-: изменяется периодически;
+: возрастает.
I: {{113}}
S: При постоянной температуре скорость химической реакции прямо пропорциональна произведению молярных концентраций реагирующих веществ в степени их стехиометрических коэффициентов – это формулировка
+: закона действия масс;
+: закона Гульдберга и Вааге;
-: закона Гесса;
-: первого закона термодинамики.
I: {{114}}
S: Установите соответствие между изменением энергии Гиббса и возможностью или невозможностью протекания процесса
L1: больше нуля
L2: меньше нуля
L3:
L4:
R1: процесс термодинамически запрещён
R2: процесс термодинамически разрешён
R3: в системе наступило равновесие
R4: отправная точка для начала реакции
I: {{115}}
S: Процесс при ΔG = 0
-: термодинамически разрешён;
-: термодинамически запрещён;
+: в системе наступило равновесие;
+: не происходит изменений.
I: {{116}}
S: Энтальпия образования оксида углерода(II), если при взаимодействии 1 моль углерода и 0,5 моль кислорода выделилось 110,53 кДж тепла, равна
-: +110,53 кДж/моль;
-: +221,06 кДж/моль;
-: –221,06 кДж/моль;
+: –110,53 кДж/моль.
I: {{117}}
S: Изменение энтропии (DSо) реакции NH3(г) + HCℓ(г) = NH4Cℓ(кр)
(Sо(NH4Cℓ(кр)) = 95,81 Дж/моль×K; Sо(NH3(г)) = 192,66 Дж/моль×K;
Sо(HCℓ(г)) = 186,79 Дж/моль×K) равно
-: +192,66 Дж/K;
+: –283,64 Дж/K;
-: +186,79 Дж/K;
-: –95,81 Дж/K.
I: {{118}}
S: Скорость прямой реакции Н2(г) + Сℓ2(г) ↔ 2HСℓ(г) при повышении давления в 4 раза возрастет в ### раз (запишите число с точностью до целых)
+: 16
I: {{119}}
S: Температурный коэффициент скорости реакции равен ###, если при повышении температуры на 60° скорость реакции увеличилась в 64 раза (запишите число с точностью до целых)
+: 2
I: {{120}}
S: Выражение константы равновесия реакции CO(г) + H2 (г) ↔ H2O(г) + C (графит)
+: Кр = [H2O]/[CO][H2];
-: Кр = [CO]/[C];
-: Кр = 1/[H2O];
-: Кр = [CO]/[H2O].
I: {{121}}
S: Равновесие реакции СО(г) + 3H2(г) ↔ СH4(г) + H2O(г) при понижении давления сместится
-: в сторону конечных продуктов;
+: в сторону исходных веществ
-: не сместится;
-: проходит через максимум концентраций.
I: {{122}}
S: Система, которая обменивается с внешней средой только энергией, называется
+: закрытой;
-: открытой;
-: изолированной;
-: гомогенной.
I: {{123}}
S: Если в каком-нибудь процессе энергия одного вида исчезает, то вместо нее появляется энергия в другой форме в количестве, строго эквивалентном первому – это формулировка
+: первого закона термодинамики;
-: второго закона термодинамики;
-: третьего закона термодинамики;
-: нулевого закона термодинамики.
I: {{124}}
S: Сумма показателей степеней концентраций в уравнении, выражающем зависимость скорости реакции от концентраций, называется
+: формальный порядок химической реакции;
-: кинетический порядок химической реакции;
-: скорость химической реакции;
-: тепловой эффект химической реакции.
I: {{125}}
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 2089; Нарушение авторских прав?; Мы поможем в написании вашей работы!