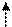КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Возможные значения квантовых чисел
|
|
|
|
| n | l | ml | ms |
| ±1/2 | |||
| 0, 1 | 0; 1, 0, –1 | ±1/2 | |
| 0, 1, 2 | 0; 1, 0, –1; 2, 1, 0, –1, –2 | ±1/2 | |
| 0, 1, 2, 3 | 0; 1, 0, –1; 2, 1, 0, –1, –2; 3, 2, 1, 0, –1, –2, –3 | ±1/2 |
| Форма s-электронной орбитали | Форма d-электронной орбитали | |||
| 
| |||
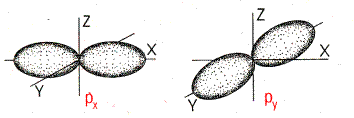
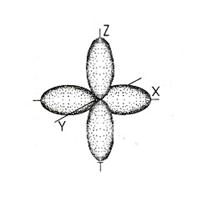
| Форма и ориентация p-электронных орбиталей | ||||

| ||||
Пространство вокруг ядра, в котором наиболее вероятно нахождение электрона, называется орбиталью.
Совокупность электронов с одинаковым квантовым числом n называется электронным слоем или уровнем. Электроны, которые движутся в орбиталях близкого размера и образуют энергетические уровни. Они номеруются от ядра 1;2;3;4;5;6;7.
Энергетические уровни подразделяются на подуровни, которые отличаются друг от друга энергией связи с ядром. Совокупность электронов с одинаковыми значениями n и 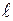 образуют подуровень.
Число подуровней равно n, но не более 4–х. образуют подуровень.
Число подуровней равно n, но не более 4–х.
|
| Подуровни состоят из орбиталей: s– первый подуровень состоит из одной s- орбитали; p – второй подуровень состоит из трёх p-орбиталей; d– третий подуровень состоит из пяти d-орбиталей; f – четвёртый подуровень состоит из семи f-орбиталей. |
Схема подразделения энергетических уровней на подуровни
 |
Электронные формулы – показывают распределение электронов по энергетическим уровням и подуровням.
число впереди формулы – номер уровня;
буква – подуровень (тип орбитали);
индекс справа вверху – число электронов на подуровне.
5.3.Основные положения строения электронных оболочек атома
| Принцип Паули | |
| В каждой орбитали может находиться не более 2-х электронов. В атоме не может быть двух электронов, обладающих одинаковыми свойствами. Поскольку свойства электронов характеризуются квантовыми числами, принцип Паули часто формулируется так: В атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковы. | Если в орбитали 1 электрон – это неспаренный электрон. Если в орбитали 2 электрона, то это спаренные электроны. |
| Правило Гунда | |||||||||||
| Порядок заполнения электронами подуровней формулируется правилом Гунда: в подуровнях p-, d- и f-орбитали сначало заполняются одиночными, неспаренными электронами и лишь потом происходит их заполнение вторыми электронами, т.е. спаривание. Иными словами, при заполнении электронами подуровня суммарное спиновое число подуровня должно быть максимальным. | Например, состояние (I) имеет суммарное спиновое число S ms = +1/2–1/2+1/2=+1/2, а состояние (II) того же подуровня с тем же числом электронов имеет S ms = +1/2+1/2+1/2=+3/2. Второму состоянию отвечает большее суммарное спиновое число, и это состояние предпочтительнее первого.

p p I II |
| Правило Клечковского | |
Сначала заполняются те подуровни, для которых сумма значений квантовых чисел n и 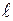 является наименьшей. является наименьшей.
| Энергия электрона в основном определяется главным квантовым числом n и побочным квантовым числом 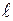 . .
|
| Принцип наименьшей энергии | |
| При заполнении электронами уровней и подуровней последовательность размещения электронов в атоме должна отвечать как наименьшей энергии электрона, так и наименьшей энергии атома в целом. Электрон не занимает вышележащий уровень, если в нижележащем уровне есть места, располагаясь на которых, он будет обладать меньшей энергией. | Принцип наименьшей энергии справедлив только для основных состояний атомов. В возбужденных состояниях электроны могут находиться на любых орбиталях атомов, если при этом не нарушается принцип Паули. |
Максимальное число электронов:
– на орбитали (определенные n, 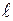 , ,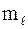 ) – 2
подуровень s p d f
максимальное число электронов 2 6 10 14
– на подуровне(определенные n и ) – 2
подуровень s p d f
максимальное число электронов 2 6 10 14
– на подуровне(определенные n и 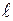 ) – 2 (2 ) – 2 (2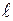 +1)
– на уровне – 2 n 2 +1)
– на уровне – 2 n 2
|
«Проскок» электрона: формула 24Cr 1s2 2s2 2p6 3s2 3p6 3d4 4s2 не соответствует действительности, т.к. второй электрон с внешнего уровня «перескочил» на d-подуровень второго снаружи уровня → 24Cr 1s2 2s2 2p6 3s2 3p6 3d5 4s1.
«Проскок» электрона характерен на d-орбитали, так как более устойчивыми состояниями являются размещение 5-ти или 10-ти электронов. То же у f-орбитали – 7 или 10 электронов.
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 497; Нарушение авторских прав?; Мы поможем в написании вашей работы!