КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ряд последовательного заполнения электронами орбиталей
|
|
|
|
|
| ↑↓ Ячейка (клетка) – орбиталь; Стрелка – электрон; Направление стрелки – направление спина; Свободная клетка – свободная орбиталь. |
| Элемент | Графические электронные формулы | Подробная электронная формула |
| 6С | 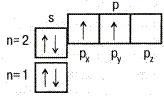
| 1s22s22p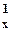 2p 2p
|
| 7N | 
| 1s22s22p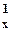 2p 2p 2p 2p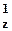
|
| 8O | 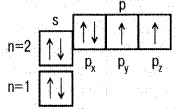
| 1s22s22p 2p 2p 2p 2p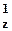
|
| Электронное строение атомов в основном состоянии приведены в Приложении И. |
| Тип элементов (семейство)– зависит от того, какой подуровень заполняется электронами последним. | s - элементы. Заполняется электронами s-подуровень внешнего уровня – первые два элемента каждого периода периодической системы Менделеева. |
| p - элементы. Заполняется p-подуровень внешнего уровня – это последние 6 элементов каждого периода (кроме первого и седьмого периодов). | |
| d - элементы. Заполняются d-подуровень второго снаружи уровня, а на внешнем уровне остается 1 или 2 электрона (у палладия – ноль). К ним относятся элементы вставных декад больших периодов, расположенных между s и p-элементами (переходные элементы). | |
| f - элементы. Заполняется f-подуровень третьего снаружи уровня, а на внешнем уровне остается 2 электрона – это лантаноиды и актиноиды. | |
| Д.И. Менделеевпредложил клеточный вариант таблицы элементов, разбив её на 7 периодов и 8 групп. Период – это горизонтальный ряд элементов, расположенных по мере возрастания заряда ядра. Каждый период начинается типичным металлом и заканчивается типичным неметаллом. Группа–это вертивертикальный ряд элементов представленный элементами аналогами. Элементы аналоги имеют одинаковое электронное строение последнего энергетического уровня, поэтому обладают близкими свойствами. Современная таблица Д.И. Менделеева приведена в Приложении В. |
Периодический закон: свойства химических элементов, а также формы и свойства соединений элементов находятся в периодической зависимости от заряда ядер их атомов.
1. Порядковый номер – равен заряду ядра и количеству электронов.
2. Номер периода – количество уровней.
3. Номер группы – максимальная положительная степень окисления.
Периодичность объясняется определенной повторяемостью в заполнении электронных уровней. Чем больше атомный радиус, тем слабее удерживаются внешние электроны, тем больше восстановительная активность атома.
По периоду с увеличением заряда ядра радиус атома уменьшается.
По группе с увеличением заряда ядра радиус атома увеличивается.
Энергия ионизации –энергия, необходимая для отрыва наиболее слабо связанного электрона от атома. При отрыве от атома образуется катион. График зависимости энергии ионизации от порядкового номера элементаприведенв Приложении Б.
Сродство к электрону – энергия, которая выделяется при присоединении к атому одного электрона. Выражается в электрон-вольтах. При присоединении электронов к атому образуется анион.
| Электроотрицательность – способность атома в соединение притягивать к себе электроны. Самый электроотрицательный элемент – фтор F. По периоду с увеличением заряда ядра электроотрицательность атомов увеличивается. По группе с увеличением заряда ядра – уменьшается. |
| Относительные значения электроотрицательности элементов приведены в Приложении Б. |
Раздел 6. Химическая связь

Ковалентная связь – химическая связь, осуществляемая за счет образования общей электронной пары.
Соединения с ковалентной связью образуют молекулярные или атомные кристаллические решетки.
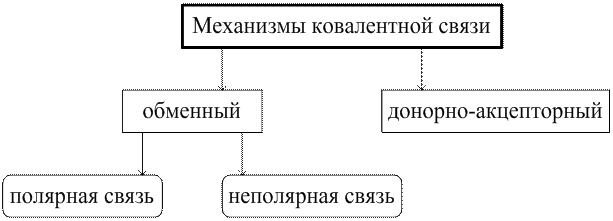
Обменный механизм происходит за счет перекрывания электронных облаков.
 |
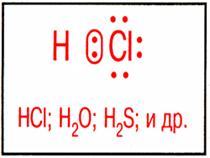
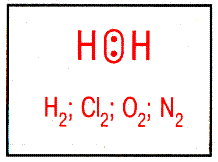
| Неполярная ковалентная связь – электронное облако, образованное общей парой электронов, распределяется в пространстве симметрично относительно ядер обоих атомов. | Полярная ковалентная связь – электронное облако связи смещено к атому с большей относительной электроотрицательностью. |



| Донорно-акцепторный механизм происходит за счёт двухэлектронного облака атома (донора) и свободной орбитали другого атома (акцептора). Связь называется донорно-акцепторной или координационной. |
Например, ион NH4+ образуется за счёт образования четвёртой связи азотом из аммиака с ионом водорода:
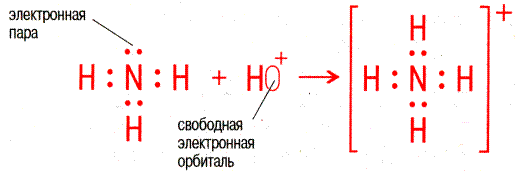 В данном случае азот является донором, а водород – акцептором. Ион, образованный за счет координационной связи, называется комплексным ионом, а соединения, содержащие подобные ионы, – комплексными соединениями.
В данном случае азот является донором, а водород – акцептором. Ион, образованный за счет координационной связи, называется комплексным ионом, а соединения, содержащие подобные ионы, – комплексными соединениями.
|
| Изображение химической связи | |||
1) С помощью электронов в виде точек, поставленных у знака химического элемента.

| |||
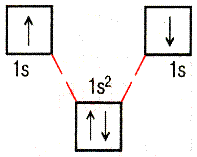 2) С помощью кватовых ячеек. 2) С помощью кватовых ячеек.
или
| |||
3) В виде чёрточки, которая символизирует пару электронов.

|
| Свойства ковалентной связи |
| 1) Длина связи – это межъядерное расстояние. |
| 2) Энергия связи – количество энергии, которое необходимо для разрыва связи; измеряется в кДж/моль. |
| 3) Насыщаемость – способность атомов образовать ограниченное число ковалентных связей. Например: Н образует 1 связь, С - не более 4 связей. |
| 4) Направленность связи обусловливает пространственную структуру молекул, т. е. их геометрию (форму). |
| Способы перекрывания электронных облаков | |
| σ -связь – перекрывание электронных облаков вдоль оси, соединяющей центры атомов. | π -связь – связь, возникающая между атомами, когда перекрывание электронных облаков происходит по обе стороны от линии, соединяющей ядра обоих атомов. |

| 
|
| Гибридизация– выравнивание взаимодействующих орбиталей разных подуровней по форме и энергии. При этом расчетные формы новых орбиталей отличаются от исходных. | ||||
| sp-гибридизация | sp2- гибридизация | |||
| 
|
| Ионнаяилиэлектровалентная связь – химическая связь между ионами, осуществляемая электростатическим притяжением. Образуется при взаимодействии атомов, которые сильно различаются по электроотрицательности. | ||||
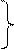 Например: NaCl X(Na) = 1,01 Например: NaCl X(Na) = 1,01
Cl 1s22s22p63s23p5 → Cl0 + ē → Cl– 1s22s22p63s23p6
|
| Свойства ионной связи | |
| Ненаправленность. Каждый ион, представляющий как бы заряженный шар, может притягивать ион противоположного знака по любому направлению. | |
| Ненасыщаемость. Взаимодействие ионов противоположного знака не приводит к компенсации силовых полей, способность притягивать по другим направлением остается. | |
| Полярные молекулы – молекулы при общей нейтральности представляют собой электрический диполь. Например: HCl. | 
|
гдеμ – электрический момент диполя. Мера полярности связи и молекулы. Выражается в Кл·м (Кулон-метр) от 0 до 3,33 Кл·м; q – эффективный заряд, заряд атома в молекуле; l – расстояние между противоположно заряженными центрами диполя. |
| Поляризуемость – способность атомов, ионов и молекул приобретать дипольный момент (µ) в электрическом поле. |
| Неполярные молекулы – молекулы, содержащие неполярную ковалентную связь – электронное облако симметрично по отношению к ядрам обоих атомов, µ = 0. Например: H2, O2, F2, Cl2 и др. |
| Металлическая связь –связь, которую осуществляют относительно свободные электроны между ионами или атомами металлов в кристаллической решетке. Наличие свободных электронов в решетки обуславливает проводимость электричества и тепла, металлический блеск. Ионы и атомы металла непосредственно не связаны, и их слои могут отдельно перемещаться относительно друг друга, отсюда ковкость и пластичность металлов. |
Кристаллическая решетка Na
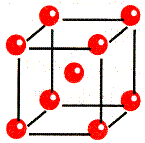 Схема
Схема
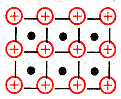
|
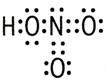
| Водородная связь – связь между атомом водорода, соединенным с атомом сильно электроотрицательного элемента, одной молекулы и сильно электроотрицательными (F, O, N) элементами другой молекулы. Возможно образование внутримолекулярной водородной связи. Обозначают точками, так как водородная связь в 15-20 раз слабее ковалентной. Водородная связь оказывает влияние на свойства вещества, так как нужна дополнительная энергия для разрыва водородной связи. |
Вода – Н2О
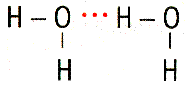 уксусная кислота – СН3СООН
уксусная кислота – СН3СООН

|
| Кристаллическая решетка – пространственный каркас, который возникает, если обозначить все частицы в кристалле в виде точек и соединить эти точки пересекающимися прямыми линиями. Узлы кристаллической решетки – точки, в которых размещены частицы. |
| Типы кристаллических решеток | |||
| Ионная решетка – состоит из ионов, ее образуют вещества с ионной связью. | Кристаллическая решетка NaCl
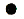 

| ||
| Молекулярная решетка – состоит из молекул, соединенных между собой слабыми межмолекулярными силами. | Кристаллическая решетка йода I2
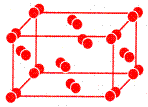
| ||
| Атомная решетка –в узлах находятся атомы, которые соединены между собой прочной ковалентной связью; вещества тверды, прочны, не растворимы в воде, имеют высокую температуру плавления. | Кристаллическая решетка алмаза С
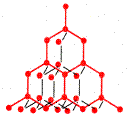
|
| Структурные формулы | ||||
| Название | молекула | |||
| водорода | воды | аммиака | метана | |
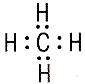
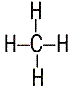
| эмпирические формулы | H2 | H2O | NH3 | CH4 |
| электронные формулы | H: H | 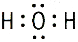
| 
| 
|
| структурные формулы | Н – Н | Н – О – Н | 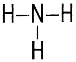
| 
|
| Степень окисления – это условный заряд атома в соединении, вычисленный исходя из предположения, что оно состоит только из ионов. | ||||
| Отрицательное значениестепени окисления имеют атомы, которые приняли электроны от других атомов, то есть в их сторону смещено связующее электронное облако. Например: Na+ | Положительное значениестепени окисления имеют атомы, отдающие свои электроны другим атомам, то есть связующее электронное облако оттянуто от них. Например: Cl– | Нулевое значениестепени окисления имеют атомы в молекулах простых веществ, электронное облако в равноймере принадлежит обоим атомам. Например: Na, Cl2, O2, H2 | ||
Алгебраическая сумма степеней окисления атомов в соединении всегда равна нулю:
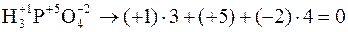 ;
а в сложном ионе – заряду иона: ;
а в сложном ионе – заряду иона:
 x= +6.
x= +6.
| ||||
| Валентность– способность атомов элемента образовывать химические связи. Количественной мерой является число связей, образованных данным атомом с другими атомами или атомными группами. Валентность химических элементов принято определять числом ковалентных связей, которыми данный атом соединен с другими атомами. Валентность элементов определяется также числом электронных пар, образующих химическую связь. | ||||
Например: азот – N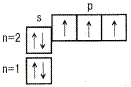

| ||||
| Валентность N = 3 | ||||
| Азот – N2 | 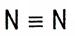
| |||
| Гидразин – N2H4 | 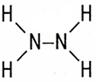
| |||
| Аммиак – NH3 | 
| |||
| Валентность N = 4 | ||||
Ион аммония – NH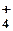
| 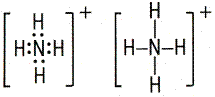
| |||
| Валентность N = 5 | ||||
| Азотная кислота – HNO3 | 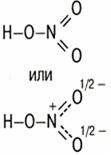
| |||
Раздел 7. Химическая кинетика и равновесие
| Учение о скоростях и механизмах химических реакций называется химической кинетикой. | |
| Под скоростью химической реакциипонимают изменения концентрации одного из реагирующих веществ в единицу времени в единице объема для гомогенной (однородной) системы и на границе раздела фаз для гетерогенной системы. | |
| Фаза – совокупность всех однородных частей системы, обладающих одинаковым химическим составом и одинаковыми свойствами. | |
| Гомогенные системы – системы, состоящие из одной фазы. Реакции, протекающие в ней, называются гомогенными. Химическая реакция в гомогенных системах протекает по всему объёму системы. | Гетерогенные системы –системы, содержащие две и более число фаз. Реакции, протекающие в них, называются гетерогенными. Реакции в гетерогенных системах протекают на поверхности раздела фаз. |
| Например: 2NH3 + 3Cl2 = 6HCl + N2 (все вещества находятся в газообразном состоянии) 2KOH + H2SO4 = K2SO4 + 2H2O (все вещества находятся в жидком растворе) | Например: CO2(газ) + С(тв) = 2СО(газ) (реакция протекает на поверхности углерода) Mg(тв) + 2HCl(ж) = MgCl2(ж) + Н2(газ) (реакция протекает на поверхности магния) |
| Обратимость химических реакций | |
| Все химические реакции можно разбить на две группы: необратимыеи обратимые реакции. | |
| Необратимые реакции протекают до конца – до полного израсходования одного из реагирующих веществ. | Обратимые реакции протекают не до конца: при обратимой реакции ни одно из реагирующих веществ не расходуется полностью. Обратимая реакция может протекать как в прямом, так и в обратном направлениях. |
| Например: Zn(тв) + 2HCl(ж) = ZnCl2(ж) + H2(газ) | Например: N2(газ) + 3Н2(газ) ↔ 2NH3(газ) |

| Основные законы химической кинетики | ||
| Зависимость скорости от концентрации определяется законом действия масс: Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, возведенных в степень их коэффициентов в уравнении реакций. | ||
| Для обратимой реакции: аА + bВ ↔ сС + dD υпр = kпр•C(A)a•C(B)b, υобр = kобр•С(C)c•C(D)d, где υпр., υобр. – скорости прямой и обратной реакций, моль/л∙с; | ||
| C(А), C(B), С(C), C(D)– концентрации веществ А, В, С, D, моль/л; | ||
| kпр, kобр – константы скорости прямой и обратной химической реак ции, которые зависят от химической природы реагирующих веществ, температуры и наличия катализатора; | ||
| a, b, c, d – стехиометрические коэффициенты в уравнении реакций. | ||
| Например, для гомогенной обратимой системы: 2SO2 + O2 = 2SO3: выражения скоростей реакции будет:υпр. = kпр•C2(SO2)•C(O2); υобр. = kобр•С2(SO3). | Например, для гетерогенной реакции: 3Fe(к)+4Н2О(газ)=Fe3O4(тв)+4Н2(газ) выражения скоростей реакции будет: υпр. = kпр•C4(Н2О); υобр. = kобр•С4(Н2). | |
| Химическое равновесие –термодинамическое равновесие в системе, в которой возможны прямые и обратные химические реакции. При химическом равновесии скорости всех реакций в двух противоположных направлениях равны между собой, поэтому в системе не наблюдается изменений макроскопических параметров, в том числе концентраций реагирующих веществ. Количественной характеристикой химического равновесия является константа равновесия (Кравн.). | ||
Для обратимой реакции в состоянии равновесия:
аА + b В ↔ сС + dD,
Vпр = Vобр,
kпр•[А]a•[В]b = kобр•[С]c•[D]d,
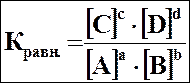 . .
| ||
Например, для гомогенной реакции N2 +3H2 = 2NH3 константа равновесия будет равна:
 , ,
| Например, для гетерогенной реакции
3 Fe(тв) +4Н2О(г) = Fe3O4(тв) + 4Н2(г) 
| |
| где [NH3], [N2], [Н2], [Н2О] – концентрации веществ в состоянии равновесия (равновесные концентрации), моль/л. | ||
| Правило Вант-Гоффа | ||
| При изменении температуры на каждые 10˚ скорость большинства реакций изменяется в 2-4 раза. | ||
| V1, V2 – скорость реакции соответственно, при t1 – начальная температура, t2 – конечная температура, | |
| γ – температурный коэффициент скорости реакции. |
| Принцип Ле Шателье-Брауна |
| Если на систему находящуюся в истинном равновесии, оказывают воздействие извне путем изменения какого либо из условий, определяющих состояние равновесия, то оно смещается в направлении того процесса, протекание которого ослабляет эффект произведенного воздействия. |
| Изменение условий | Направление смещения | |
| Температура | ↑ повышение | Смещается в сторону эндотермической реакции (∆Н˚>0). |
| ↓ понижение | Смещается в сторону экзотермической реакции (∆Н˚<0). | |
| Давление | ↑ повышение | Равновесие реакции между газами смещается в сторону реакции, идущей с уменьшением объема. |
| ↓ понижение | Равновесие реакции между газами смещается в сторону реакции, идущей с увеличением объема. | |
| Концентрация исходных веществ | ↑ повышение | Равновесие смещается в сторону продукта реакции. |
| ↓ понижение | Равновесие смещается в сторону исходных веществ. | |
| Например, как следует изменить температуру, давление и концентрацию исходных веществ в системе ZnS(тв)+3О2 (г) → 2ZnO(тв)+2SO2 (г), ∆Н˚<0, чтобы повысить выход оксида цинка? Ответ: согласно принципу Ле-Шателье температуру необходимо понизить, т.к. реакция экзотермическая; давление повысить, т.к. реакция идет с уменьшением числа газовых фаз; концентрацию исходных веществ увеличить. |
| Энергия активации |
| Активация– процесс превращения неактивных частиц в активные путем сообщения им дополнительной энергии. |
| Энергия, которую надо сообщит молекулам (частицам) реагирующих веществ, чтобы превратить их в активные – энергия активации. Обозначается в Еа, выражается кДж/моль. |
| Изменение энергии реагирующей системы | |||
А2 + В2 = 2АВ
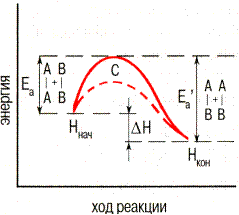 Необходимо преодолеть энергетический барьер С. Необходимо преодолеть энергетический барьер С.
| Ннач –энергия исходного состояния (исходные вещества) | ||
| Нкон – энергия конечного состояния (продукты реакции) | |||
| Еа – энергия активации прямой реакции | |||
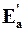 – энергия активации обратной реакции – энергия активации обратной реакции
| |||
 
| |||
| ΔН – тепловой эффект реакции | |||
|
Раздел 8. Химическая термодинамика
| Химическая термодинамика –область химической науки, ориентирующаяся на изучение превращений энергии в химических процессах и способности химических систем выполнять полезную работу. |
| Химическая система –совокупность реагирующих веществ, отделённая от внешней среды реальной (например, стенкой реакционного аппарата) или условной границей (поверхностью). Далее для краткости химическая система называется просто системой. Системы подразделяются на изолированные, закрытые и открытые. | ||
| Изолированная система –система, не обменивающаяся с внешней средой ни веществом, ни энергией. | Закрытая (замкнутая) система – система, не обменивающаяся с внешней средой веществом, но для которой сохраняется возможность энергетического обмена с внешней средой. | Открытая система – система, обменивающаяся с внешней средой и веществом и энергией. |
8.1. Параметры состояния системы
| –физические и химические свойства системы (объём, давление, температура, химический состав и т. д.), выбранные в качестве независимых переменных, однозначно определяющих состояние системы. |
| Давление (Р) характеризует подвижность молекул и определяется силой действия газообразных частиц на стенки сосуда. Давление измеряют в Па (паскаль), но используются и внесистемные единицы: атмосфера (атм.), миллиметры ртутного столба (мм рт. ст.) и другие. 1атм=101,32кПа=760 мм рт. ст. |
| Объем (V) характеризует часть пространства, занимаемую веществом, и определяется энергией взаимодействия молекул между собой. Измеряют в м3, дм3, см3. 1дм3 = 1л; 1см3 =1мл. |
| Температура (T, t) характеризует степень нагретости системы, среднюю кинетическую энергию частиц вещества. Системой единиц СИ допускается применение двух температурных шкал: термодинамической шкалы Кельвина (К) и стоградусной шкалы Цельсия (˚С): 1К = 273˚С. |
| Концентрация вещества (С) определяет количественный состав раствора, смеси или расплава. Измеряется в моль/л. |
| Параметры состояния, пропорциональные количеству вещества системы, называются экстенсивными (объём, масса, заряд и т. д.). Параметры состояния, не зависящие от количества вещества системы, называются интенсивными. |
| Равновесиемназывается такое состояние системы, при котором её свойства неизменны во времени и в ней отсутствуют потоки вещества и энергии (неизменность свойств системы во времени при наличии в этой системе потоков вещества или энергии характеризуетстационарность системы). |
| Внутренняя энергия системы (U) – сумма всех видов энергии движения и взаимодействия составляющих систему структурных единиц (молекул, атомов, электронов, ядер) за исключением кинетической энергии системы как целого и потенциальной энергии системы как целого в полях внешних сил. |
 Энтальпия системы(Н) –функция состояния системы, определяемая следующим равенством:
где р – внешнее давление,оказываемое внешней средой на систему;
V – объём системы (для процессов, происходящих в системе при постоянном внешнем давлении, изменение энтальпии соответствует поглощённой или выделенной теплоте, т. е. ΔHр = δQ). Энтальпия системы(Н) –функция состояния системы, определяемая следующим равенством:
где р – внешнее давление,оказываемое внешней средой на систему;
V – объём системы (для процессов, происходящих в системе при постоянном внешнем давлении, изменение энтальпии соответствует поглощённой или выделенной теплоте, т. е. ΔHр = δQ).
|
| Тепловой эффект (энтальпия) химической реакции (ΔrH) – количество теплоты, выделяемой или поглощаемой в результате реакции при постоянном давлении или объёме, равенстве температур исходных веществ и продуктов и отсутствии всех видов работ, кроме работы расширения. Тепловой эффект реакции с количествами веществ, указанными в уравнении, осуществляемый при постоянном давлении 101,3 кПа, рассчитываемый на температуру 298 К, называется стандартным тепловым эффектом и обозначается символом ΔrH0298. |
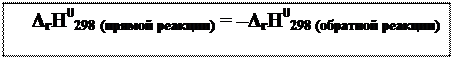 ПриΔrH0298 > 0 – эндотермический процесс (поглощение теплоты извне), если ΔrH0298 < 0 – экзотермический процесс (выделение теплоты). Тепловой эффект реакции измеряется в кДж. Если при протекании прямого процесса химической реакции выделяется (поглощается) некоторое количество теплоты, то при обратном процессе данной реакции в тех же условиях такое же количество теплоты поглощается (выделяется). ПриΔrH0298 > 0 – эндотермический процесс (поглощение теплоты извне), если ΔrH0298 < 0 – экзотермический процесс (выделение теплоты). Тепловой эффект реакции измеряется в кДж. Если при протекании прямого процесса химической реакции выделяется (поглощается) некоторое количество теплоты, то при обратном процессе данной реакции в тех же условиях такое же количество теплоты поглощается (выделяется).
|
| Стандартная теплота (энтальпия) образования вещества (ΔfH0298) – стандартный тепловой эффект реакции образования 1 моль вещества из простых веществ. Энтальпия образования вещества измеряется в кДж/моль. Значение ΔfH0298 для большинства известных веществ находятся в справочниках термодинамических функций. | Стандартная теплота (энтальпия) сгорания вещества (ΔсH0298) – стандартный тепловой эффект реакции сгорания 1 моль вещества в кислороде. Энтальпия сгорания вещества измеряется в кДж/моль. |
8.2. Закон Гесса
| Тепловой эффект химической реакции зависит только от начального и конечного состояния веществ и не зависит от промежуточных стадий процесса. |
| Следствие: тепловой эффект реакции равен сумме теплот (энтальпий) образования продуктов за вычетом суммы теплот (энтальпий) образования исходных веществ с учётом стехиометрических коэффициентов. |
Например, для реакции:
aA + bB = cC + dD тепловой эффект равен
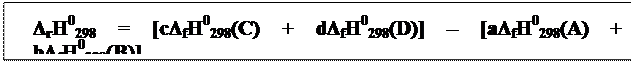
|
| Термохимия– раздел химии, посвященный количественному изучению тепловых эффектов реакций. |
| Термохимические уравнения– химические уравнения реакций, в которых указано изменение энтальпии. |
| Например, СО(г) + 0,5О2(г) = СО2(г), ΔrH0298 = –283,0 кДж При записи термохимических уравнений указывается агрегатное состояние веществ, а также допускается запись дробных коэффициентов. |
Энтропия (S) – понятие, характеризующие возможные состояния вещества. Любому макросостоянию вещества отвечает большое разнообразие микросостояний. Это обусловлено тем, что частицы вещества – ионы, атомы, молекулы совершают непрерывные колебательные движения, переходя каждый раз из одного микросостояния в другое. Чем больше отдельных микросостояний, тем больше беспорядок системы. Мерой беспорядочности и является энтропия:
 где R – газовая постоянная;
W – вероятность макросостояния.
где R – газовая постоянная;
W – вероятность макросостояния.
|
| Энтропию относят к 1 моль вещества и обозначают в стандартных условиях – S0298. Энтропия веществ измеряется в Дж/моль·К. |
Энтропия реакции ΔrS0 равна разности между суммой энтропий продуктов реакции и суммой энтропий исходных веществ с учетом стехиометрических коэффициентов.
Например, для реакции: aA + bB = cC + dD

| ||||
| Химическое сродство или движущая сила химической реакции определяется изменением свободной энергии системы, т.е. энергией Гиббса ΔrG, а в стандартных условиях – стандартной энергией Гиббса ΔrG0298. При вычислении стандартных изменений энергии Гиббса реакций используют стандартные энергии Гиббса образования веществ ΔfG0298. | ||||
Например, для реакции: aA + bB = cC + dD
|
| Энергия Гиббса образования ΔfG0298 соединения измеряется в кДж/моль, а энергия Гиббса реакции ΔrG0298 в кДж. | ||
где Т – абсолютная температура. |
| Возможность протекания реакции |
| При постоянных значениях давления (Р), температуры (Т) в стандартных условиях самопроизвольно протекают такие реакции, для которых ΔrG0298 < 0. Чем меньше алгебраическая сумма ΔrG0298 реакции, тем больше ее движущая сила. В ходе реакции ΔrG0298 увеличивается и при ΔrG0298 = 0 в системе устанавливается состояние равновесия. Если ΔrG0298 > 0, то реакция не может идти без затрат энергии извне, а при ΔrG0298 >> 0 реакция термодинамически невозможна. |
| Термодинамические функции образования простых веществ и элементов ΔfG0298 и ΔfH0298 в стандартных состояниях равны нулю. |
| Значения стандартной энергии Гиббса образования соединений ΔfG0298, энтальпии образования соединений ΔfH0298 и энтропии простых веществ и соединений стандартны и приведены в таблице в Приложении К. |
Раздел 9. Химия элементов
Элементы IIIА группы
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 946; Нарушение авторских прав?; Мы поможем в написании вашей работы!


 Х(Сl) = 2,85
Х(Сl) = 2,85