
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Соединения n
|
|
|
|
АЗОТ N
N, P, As, Sb, Bi
Общая характеристика
  N
P
As
Sb N
P
As
Sb
 Bi Bi
s p Степень окисления ns2np3 – последний уровень
|
| В природе:в воздухе в свободном состоянии; в почве в виде соединений; в белковых веществах и органических соединениях. |
| Получение: 1) В промышленности: воздух переводят в жидкое состояние, далее испарением отделяют азот от кислорода. 2) В лаборатории – термическим разложением нитрита аммония: NH4NO2 = N2↑ + 2H2O. |
| Физические свойства:N2 – газ без цвета, запаха и вкуса, чуть легче воздуха, мало растворим в воде. Ткипения = 196˚С |
Химические свойства
Степени окисления: +1, +2, +3, +4, +5, –1, –2, –3
 N≡N – молекула азота, прочная связь, низкая реакционная способность.
N2 + 6Li = 2Li3N (при комн. t)
N2 + 3Ca = Ca3N2 (при высок. t) N – окислитель
N2 +3H2 = 2NH3 (t высок., Р, Кат.)
N2 + O2 = 2NO (t = 3000–4000˚C) N – восстановитель N≡N – молекула азота, прочная связь, низкая реакционная способность.
N2 + 6Li = 2Li3N (при комн. t)
N2 + 3Ca = Ca3N2 (при высок. t) N – окислитель
N2 +3H2 = 2NH3 (t высок., Р, Кат.)
N2 + O2 = 2NO (t = 3000–4000˚C) N – восстановитель
|
| Применение: для получения аммиака; для создания инертной среды; для азотирования поверхности стальных изделий с целью увеличения прочности стали; для производства минеральных удобрений. Азот имеет важное значение в жизни растений и животных. |
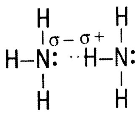
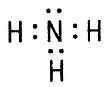 Аммиак NH3 Аммиак NH3 | Физические свойства: бесцветный газ с характерным резким запахом, в 2 раза легче воздуха. Хорошо растворим в воде – нашатырный спирт. Т кипения = –33,4˚С. Легко сжимается. |
| Химические свойства NH3 | |
| NH3 – основание | NH3 - восстановитель |
1) с кислотами образует соли
NH3+HCl=NH4Cl(хлорид аммония)
2) растворение в воде
NH3+H2О NH3·H2О NH3·H2О
| 1) 3Br2 + 8NH3 = N2↑ + NH4Br
2)  O2 +NH3→N2↑+H2О(горение)
NO+H2О(кат.Pt)
3) 3CuO+2NH3=3Cu+N2↑+3H2О O2 +NH3→N2↑+H2О(горение)
NO+H2О(кат.Pt)
3) 3CuO+2NH3=3Cu+N2↑+3H2О
|
Получение NH3:
1) В промышленности: N2 + 3H2 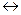 2NH3 (Кат. – губчатое железо + активатор (Al2O3 или CuO))
2) В лаборатории: 2NH4Cl + Ca(OH)2 = CаCl2 + 2NH3↑ + 2H2О (нагревание) 2NH3 (Кат. – губчатое железо + активатор (Al2O3 или CuO))
2) В лаборатории: 2NH4Cl + Ca(OH)2 = CаCl2 + 2NH3↑ + 2H2О (нагревание)
| |
| Применение:для получения азотной кислоты,солей, мочевины, соды, минеральных удобрений. |
Качественные реакции на ионы аммония:
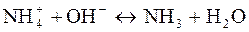 (со щелочами)
определяют по запаху аммиака или изменению цвета лакмуса (с красного на синий) (со щелочами)
определяют по запаху аммиака или изменению цвета лакмуса (с красного на синий)
|
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 830; Нарушение авторских прав?; Мы поможем в написании вашей работы!


 - 3ē
- 3ē
 - 5ē
- 5ē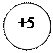 d +3 ē
d +3 ē