
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кислород
|
|
|
|
O, S, Se, Te, Po
Халькогены
СОЕДИНЕНИЯ Р
| Оксид фосфора (III) P4O6 (P2O3) Воскообразная кристаллическая масса, ядовит. | Оксид фосфора (V) P4O10 (P2O5) Белый гигроскопичный порошок. |
| Получение: 4Р+3О2=2Р2О3 (при недостатке О2) | Получение:4Р+5О2=2Р2О5 (избыток О2) |
| Химические свойства Р2О3 – кислый оксид: Р2О3+4NaOH=2Na2HPO3+H2O Р2О3+3H2O=2H3PO3 Р2О3+O2=P2O5 (Р2О3 – восстановитель) | Химические свойства 2HNO3+P2O5=2HPO3+N2O5 P2O5 – кислотный оксид: P2O5+3BaO=Ba3(PO4)2 P2O5+6NaOH=2Na3PO4+3H2O |
| Фосфорная кислота H3PO4 | ||
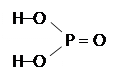 Физические свойства: белое твердое вещество, смешивается с водой. Физические свойства: белое твердое вещество, смешивается с водой.
Получение: Ca3(PO4)2+3H2SO4=2H3PO4+3CaSO4↓ P2O5+H2O=2H3PO4
| ||
| Соли фосфорной кислоты 1) фосфат – замещены все атомы Н в фосфорной кислоте: K3PO4 2) гидрофосфат – замещены 2 атома H в H3PO4: K2HPO4 3) дигидрофосфат – замещен 1атом Н в H3PO4: KH2PO4 |
Элементы VI А группы
  О – голубой О – голубой
Se – красный Te – коричневый Ро
|
| В природе:О составляет 47% земной коры, 21% воздуха. Входит в состав воды, горных пород, минеральных солей, белков, жиров, углеводов. |
| Получение: 1) В лаборатории: 2KClO3=KCl+3O2↑ (нагревание, кат. MnO2) 2KMnO4=K2MnO4+MnO2+O2↑ 2) В промышленности: из жидкого воздуха, электролизом воды. |
| Физические свойства. Аллотропные модификации | ||
| Кислород О2– газ без цвета, вкуса и запаха, немного тяжелее воздуха. В воде малорастворим. При t = –183˚C и р=101325 кПа переходит в жидкое состояние. | Озон О3 – газ с характерным запахом, разрушает органические вещества. О3 – более сильный окислитель, чем О2. О2 + энергия = 2О, О + О2 = О3 (электрический разряд) 2KI+O3+H2O=I2+2KOH+O2 (качественная реакция на О3) | |
| Химические свойства О2 | ||
1)
2) С металлами 2Mg+O2=2MgO 3) С щелочными металлами 2Na+O2=Na2O2 (пероксиды) 4) Со сложными веществами 2Fe2S3+9O2=2Fe2O3+6SO2 |
| Применение:в металлургии (для получения высоких температур); для получения HNO3, H2SO4; обжиг руд; в медицине (кислородные подушки и т.д.); в приборах для работы в подземных, подводных условиях, космических полетах. |
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 414; Нарушение авторских прав?; Мы поможем в написании вашей работы!
