
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
ЖЕЛЕЗО Fe
|
|
|
|
Fe, Co, Ni
Подгруппа железа
ХРОМ Cr
| В природе: хромистый железняк FeO·Cr2O3 |
| Получение: 1) алюмотермия Cr2O3+2Al=Al2O3+2Cr 2) электролиз солей |
| Физические свойства: хром – серовато-белый металл, тугоплавкий, Т плавления = 1875˚С, устойчив на воздухе. |
| Химические свойства:Металл средней активности, в электрохимическом ряду – … Zn Cr Fe … H. С простыми веществами: 1) 4Cr+3O2=2Cr2O3 – защитная пленка, поэтому в обычных условиях реагирует только с F2, при нагревании с Cl2, Br2, S 2) 2Cr+3Cl2=2CrCl3 (красное каление) Со сложными веществами: при нагревании – оксидная пленка растворяется и Cr реагирует с кислотами-неокислителями (до Cr2+) Cr+2HCl=CrCl2+H2 Cr+H2SO4(разб)=CrSO4+H2 |
Общая характеристика элементов
(n-1)d(6÷8)ns2 – последний уровень
4s 4s 4s
 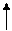    3d 3d 3d 3d 3d 3d
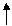  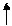 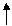                -3ē -2ē -3ē -2ē
степень степень
|
| |||
 | |||
Раздел 10. Органическая химия
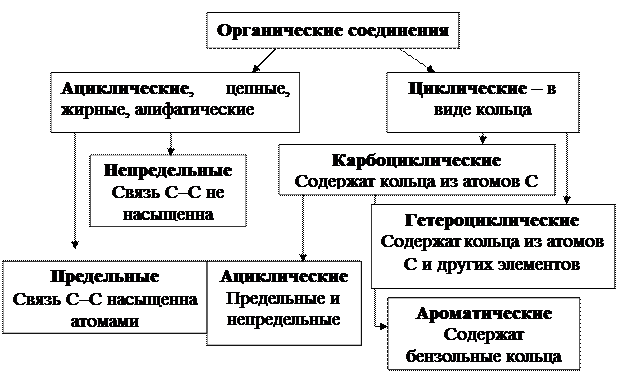
10.1.Углеводороды
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 364; Нарушение авторских прав?; Мы поможем в написании вашей работы!

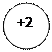


 окисления окисления
окисления окисления Fe3O4+4H2
3) 4HNO3+Fe=Fe(NO3)2+NO+2H2O
6H2SO4+2Fe
Fe3O4+4H2
3) 4HNO3+Fe=Fe(NO3)2+NO+2H2O
6H2SO4+2Fe