
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
С, Si, Ge, Sn, Pb
|
|
|
|
Ti
B, Al, Ga, In, Ti
Общая характеристика элементов
|
 |
ns2np1 – электронная формула последнего уровня
p

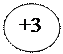 s
s




 B
B возрастают Al
возрастают Al металлические Ga
металлические Ga
 свойства In
свойства In бокситы – Al2O3·nH2O;
глины – Al2O3·nSiO2;
нефелины – KNa3[AlSiO4]4;
корунд – минерал Al2O3;
криолит – минерал AlF3·3NaF или Na3[AlF6]
бокситы – Al2O3·nH2O;
глины – Al2O3·nSiO2;
нефелины – KNa3[AlSiO4]4;
корунд – минерал Al2O3;
криолит – минерал AlF3·3NaF или Na3[AlF6]



 2Al + 6H2SO4(конц.) = Al2(SO4)3 + 3SO2↑ +6H2O
2Al + 6H2SO4(конц.) = Al2(SO4)3 + 3SO2↑ +6H2O

 растет размер атома и C
растет размер атома и C усиливаются Ge
усиливаются Ge восстановительные Sn
восстановительные Sn

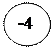 - 4ē
- 4ē
 - 2ē
- 2ē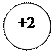 d + 4ē
d + 4ē