
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методы исследования белков в пищевом сырье и продуктах переработки
|
|
|
|
Вопросы
1. Чем отличается органолептический анализ от сенсорного анализа?
2. Каковы физиологические основы органолептического анализа?
3. Какие известны классы запахов?
4. Что называется дегустацией пищевой продукции и как она осуществляется?
5. Как производится органолептическая оценка качества пищевых продуктов?
Тесты
1. К какому вкусу наиболее чувствителен человек?
а) кислому;
б) соленому;
в) горькому.
2. Что такое органолептический анализ по определению Комитета по научно-технической терминологии Академии наук РФ?
а) сенсорный анализ пищевых продуктов, вкусовых и ароматизирующих
веществ с помощью обоняния, вкуса, осязания, зрения и слуха;
б) сенсорный анализ с помощью органов чувств, обеспечивающих организму получение информации с помощью зрения, слуха, обоняния, осязания, вкуса, вестибулярной рецепции и интерорецепции (внутренние органы).
3. Величина ощущения
а) прямо пропорциональна логарифму величины раздражения;
б) прямо пропорциональна величине раздражения;
в) обратно пропорциональна величине раздражения.
Белки или протеины (от греческого proteios - «первостепенный»).
В природе существует до 1012 различных белков, составляющих основу 106 видов животных организмов, начиная от вирусов и заканчивая человеком. Огромное разнообразие белков обусловлено способностью 20 протеиногенных α-аминокислот (табл.1) взаимодействовать друг с другом с образованием полимерных молекул с молекулярной массой от 5 тыс. до 1 млн. и более дальтон.
Таблица 1
Химическое строение и физико-химические свойства аминокислот
| Сокра- | Удельное | Раство- | |||
| щенное | Строение химического | вращение в | римость | ||
| Название | обозна- | радикала R | водном | иэт | при 25°С |
| чение | растворе при | г/100 г | |||
| 25°С [аД] | воды | ||||
| Глицин | Гли | Н- | — | 5,97 | 24,99 |
| Алании | Ала | СН3- | +1,6 | 6,0 | 16,51 |

ИЭТ - изоэлектрическая точка.
К простым белкам относятся альбумины, глобулины, проламины, глютелины, гистоны, протамины, протеноиды. В основу классификации положены их растворимость в специфическом растворителе и некоторые химические признаки (основность, кислотность). Эти свойства используются три извлечении белков из анализируемого объекта. Так альбумины водорастворимые белки с высокой гидрофильностью, обладают кислыми свойствами (изоэлектрическая точка (ИЭТ) около 4,7).
Глобулины не растворимы в воде, растворимы в слабосолевых растворах. При их извлечении (экстракции) из различных объектов используют 2-10 %- ый раствор хлорида натрия. Глобулины слабокислые или нейтральные белки (ИЭТ 3,0-7,0).
Проламины растворимы в 60-70%-ном этаноле.
Глютелины находятся, как правило, совместно с проламинами. Они не растворяются ни в солевых растворах, ни в спирте, но экстрагируются гидроксидами щелочных металлов (0,2%-ным раствором) (ИЭТ 5-7).
Протамины и гистоны обладают ярко выраженными основными свойствами из-за большого содержания аргинина (ИЭТ лежит в щелочной области 10,5-13,5) и т.д.
Белки пшеницы и зернобобовых составляют значительную долю потребляемого белка. Их состав приведен в таблице 2.
Таблица 2
Белки зерновых и зернобобовых культур при влажности 14 %
| Культура | Содержание белка, % | В том числе в % от общего белка | |||
| альбумиины | глобулины | проламины | глютелины | ||
| Пшеница | 12,5 | 5,2 | 12,6 | 35,6 | 28,2 |
| Рожь | 9,9 | 25,3 | 19,2 | 25,4 | 16,5 |
| Ячмень | 10,3 | 12,5 | 12,7 | 34,4 | 29,6 |
| Гречиха | 10,8 | 21,7 | 42,6 | 1Д | 12,3 |
| Рис | 7,4 | 10,6 | 8Д | 4,6 | 52,8 |
| Кукуруза | 10,3 | 18,0 | 13,3 | 33,9 | 23,0 |
| Горох | 20,5 | 9,6 | 85,7 | — | 4,8 |
| Соя | 34,9 | — | следы | следы |
Средний элементарный состав большинства белков (%) составляет углерод 50-54, азот 15-18, кислород 20-23, водород 6-8, сера 0-2,5. Содержание белка в различных объектах составляет, % (табл. 3).
Таблица 3
Содержание белка в различных пищевых системах
| Мышцы, сердце, печень | 15-23 | |
| Семена зернобобовых (фасоль, соя, горох) | 18-28 | |
| Семена хлебных злаков: рожь, ячмень | 8-13 | |
| Пшеница | 12-21 | |
| Стебли, листья растений | 1,5-3,0 | |
| Овощи, фрукты | 0,5- 1,7 |
Протеноиды - подгруппа фибриллярных белков. Они не растворимы ни в воде, ни в солевых растворах, ни в разбавленных кислотах и щелочах. В эту подгруппу входят коллаген, кератин, эластин, фиброин.
При исследовании белков могут возникать разнообразные задачи определение структуры белков, их аминокислотного состава, определение общего содержания белков и т.д. При этом следует учитывать, что в технологическом потоке могут происходить различные превращения белков. Изменение нативной структуры (денатурация) происходит у большей часта белков при 60-80° С.
При температуре 40-60° С начинают протекать процессы взаимодействие белков с редуцирующими сахарами, сопровождающиеся образованием карбонильных соединений и темноокрашенных продуктов-меланоидинов (реакция Майяра). Сущность реакции заключается во взаимодействии группы NH2 аминокислот с гликозидными гидроксилами сахаров.
Термическая обработка белоксодержащей пищи при 100-120°С приводит к крушению (деструкции) макромолекул белка с отщеплением функциональных групп, расщеплением пептидных связей и образованием сероводорода, аммиака, углекислого газа и ряда более сложных соединение небелковой природы. Например, образование диметилсульфида СН3-S-СН3, цистеиновой кислоты НО2С-СН(NН2)СН2SО3Н. Могут протекать реакции дезаминирования и дегидратации.

Среди продуктов термического распада белков встречаются соединения, придающие им мутагенные свойства, вызывающие наследственные изменения в ДНК.
В экстрактах, выделенных из жареной рыбы и мяса, найдены продукты пиролиза аминокислот:
В щелочных средах, особенно при высоких температурах, некоторые остатки аминокислот претерпевают ряд специфических превращений. Так аргинин превращается в орнитин, цитруллин, мочевину и аммиак, а цистеин – в цегидроаланин с выделением сероводорода и др. Для идентификации и количественного определения большого многообразия соединений в пищевых объектах применяют как классические гравиметрические и титриметрические методы, так и физико-химические методы анализа (оптические, электрохимические,хроматографические,рентгеноструктурные, методы ядерно-магнитного резонанса и др.). Использование того или иного метода зависит от цели исследования. Практически всем существующим методам анализа белков предшествует достаточно сложный процесс пробоподготовки. Основными этапами которого являются:
1. Разрушение клеточной структуры материала. В результате этого обеспечивается дальнейшее наиболее полное извлечение белков. Выбор тоге или иного способа зависит от объекта и задач исследования. Для этого используют специальные валковые или шаровые мельницы. Применяют также гомогенизаторы различной конструкции. В последнее время широко используют ультразвуковые дезинтеграторы. Применяют также метод «азотной бомбы», заключающийся в насыщении суспендированных клеток газообразным азотом под высоким давлением, которое затем резко сбрасывают, азот, проникший внутрь клеток, выделяется в виде газа и «взрывает» их. В целом, классификация методов разрушения (дезинтеграции) материала, отражающая разнообразие подходов, используемых с этой целью при выделении белков е других соединений, приведена в таблице 4.
Таблица 4
Классификация дезинтегрирующих воздействий по их природе 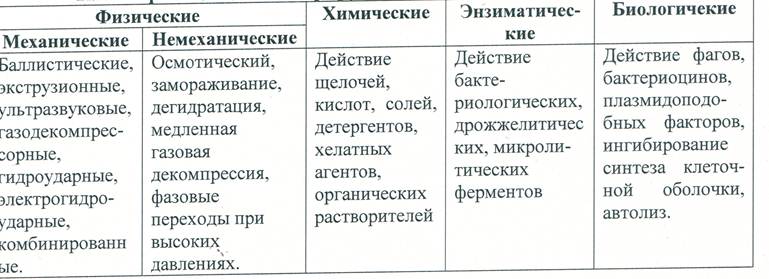
2.Экстракция белков. Когда достигнуто тонкое измельчение материала, к следующему этапу - извлечению белков. Выбирая различные экстрагенты и подбирая режимы экстракции (время, температура и т.п.) можно избирательно перевести в раствор разные группы белков.
Так, например, проводя экстракцию водой, мы переводим в раствор альбумины.
Глобулины — солерастворимые белки, экстрагируются растворами солей апример, 5-10% NаСl.
Проламины - спирторастворимые белки, экстрагируются 60-80% этанолом, а глютелины - разбавленным раствором щелочей (0,1 -0,2%).
Извлечению белков способствует обработка детергентами: додецил сульфатом натрия, дезоксихолатом натрия, тритоном х-100, алкилгликозидами и др.
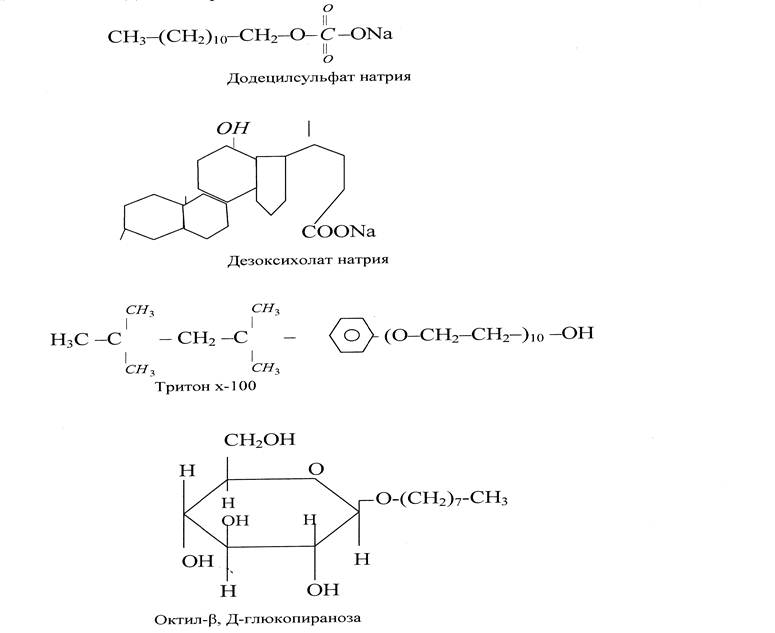
Детергенты ослабляют гидрофобные белково-липидные и белок - белковые взаимодействия, способствуют разрыву этих связей.
3. Осаждение белков. После экстракции смеси белков проводят их осаждение. Фракционирование белков проводят с помощью:
1)трихлоруксусной кислоты;
2)осаждение органическими растворителями (спиртом, ацетоном и др.);
3)высаливание белков;
4)осаждение в изоэлектрической точке, путем изменения рН белкового экстракта;
5)осаждение путем тепловой коагуляции и др.
4.Очистка белков. Для очистки белков, их фракционирования широко используют хромато графические методы: адсорбционная, ионообменная, хроматография по сродству (аффинная хроматография), метод гель-фильтрации (метод молекулярных сит), методы изоэлектрического фокусирования, электрофоретическое разделение белков и др.
Широкое распространение получил метод гель-фильтрации. В качестве геля используют препараты сефадексов различных марок, которые отличаются между собой величиной ячеек в гранулах.
Через колонку, заполненную набухшим сефадексом, пропускают исследуемый белковый экстракт. Белки, молекулы которых по своим размерам превосходят размеры ячеек в гранулах сефадекса, проходят между частицами геля и выходят из колонки раньше низкомолекулярных белков, которые задерживаются внутри гранул сефадекса. Происходит разделение белков по молекулярной массе.
Электрофоретическое разделение белков основано на том, что белки, имеющие разные по величине и знаку заряды в электрическом поле постоянного тока, будут двигаться к катоду или аноду. Скорость движения определяется величиной заряда.
Классификация методов связана с типом электролитической системы, типом носителя, конструкцией аппаратуры, а также способом обнаружения разделяемых белковых фракций.
Широкое распространение получил электрофорез в полиакриламидном геле.
Метод изоэлектрического фокусирования (ИЭФ) основан на разделении белков, имеющих разные изоэлектрические точки. ИЭФ осуществляется в процессе их электрофоретического разделения на колонке, по высоте которой создается градиент рН. Белок движется под воздействием электрического поля, пока не достигнет той области колонки, где рН равен изоэлектрической точке данного белка. Суммарный электрический заряд белка становится равным нулю; белок теряет подвижность и концентрируется в этой области в виде узкой зоны. Молекулы различных белков будут образовывать зоны в той или иной части колонки в соответствии со значениями их изоэлектрических точек. ИЭФ позволяет разделять белки, различающиеся значениями изоэлектрических точек на 0,02 единицы.
Применяются и другие разновидности электрического разделения: иммуноэлектрофорез, изотахофорез, метод пептидных карт и ультрацентрифугирование.
Для установления первичной структуры белка (последовательности расположения аминокислотных остатков в одной или нескольких полипептидных цепях) проводят ряд сложных операций (схема 2).
Определение последовательности аминокислотных остатков в индивидуальных пептидах проводят фенилизотиоцианатным методом Эдмана, масс-спектрометрическим, ферментативным, генетическим, методом лазерной ютодиссоциации, обладающего высокой чувствительностью (для анализа достаточно 5 нмоль белка при молекулярной массе 50 кДа).
В методе масс-спектрометрии фрагментацию осуществляют воздействием электронного удара, а разделение фрагментов - в масс-спектрометре. В результате получают масс-спектр фрагментов пептида (рис.2).
Схема 2
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 2191; Нарушение авторских прав?; Мы поможем в написании вашей работы!