
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Источник рентгеновских лучей
|
|
|
|
 |
|
 |
| кристалл белка |
пучок рентгеновских лучей
фотоплёнка
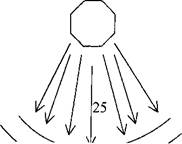
Рис.3. Схема рентгеновского кристаллографического анализа. Однонаправленный рентгеновский поток падает на белковый кристалл, который вызывает дифракцию лучей.
Определение структуры миоглобина и гемоглобина обеспечило первые представления о природе трехмерной структуры глобулярных белков.
В отличие от рентгеноструктурной кристаллографии, ядерно-магнитная резонансная (ЯМР) спектроскопия позволяет изучать белки в растворах и, следовательно, не требует трудоемкого получения кристаллов белков. ЯМР спектроскопия основана на абсорбции электромагнитного излучения молекул в магнитных полях, позволяет определять состояние спинов определенных томных ядер. При изучении белковой структуры обычно определяют спины водородных атомов.
Рентгеноструктурная кристаллография и ЯМР спектроскопия требуют больших количеств очищенного белка.
Метод дисперсии оптического вращения (ДОВ) является также одним из важнейших методов изучения белков в их водных растворах. Он основан на способности белков вращать плоскость поляризации света, падающего на их образцы. Измерение угла вращения проводят на спектрополяриметре. Однако метод ограничен в результате гидрофобных взаимодействий и ван-дерваальсовых сил.
Для исследования белков используются также УФ-спектрофотометрия. Метод основан на гипохромном эффекте, т.е. понижении поглощения света при длине волны 190 нм белком, имеющим α-спирали и β-структуры по сравнению с белком с разрушенными этими структурами.
Используют также метод электронной микроскопии, который в совокупности с вышеуказанными методами могут дать исчерпывающую информацию о структуре белка.
При анализе аминокислотного состава пищевых белков проводят полный гидролиз исследуемого экстракта белков или пептидов и определение суммарного (аминного азота) содержания аминокислот или всех аминокислот в гидролизате. Для гидролиза обычно используют 5-7 N-раствор НС1, а при анализе содержания триптофана, неустойчивого в кислой среде, раствор щелочи.
Благодаря наличию карбоксильных и аминных групп аминокислоты проявляют свои специфические реакции, которые нашли применение при разделении, идентификации и количественном определении аминокислот реакции по карбоксильным группам аминокислот протекают аналогично превращениям карбоновых кислот, т.е. образуют соли, сложные эфиры, тиоэфиры, с формальдегидом дают метильные или метиленовые производные. Сложные эфиры разных аминокислот со спиртами имеют различные коэффициенты летучести.
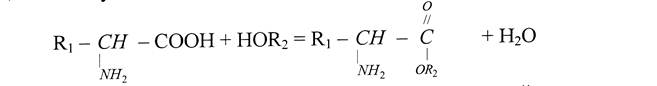
Поэтому их легко можно разделить фракционной перегонкой в вакууме.
В специфических реакциях аминокислот особую роль играет реакционная способность α-аминогруппы. Реакция с азотистой кислотой (реакция Ван-лайка) позволяет определить суммарное содержание аминокислот по выделившемуся газообразному азоту.
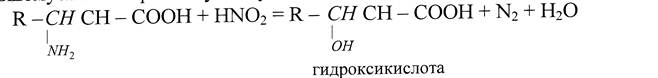
α-аминогруппа может вступать в реакцию с формальдегидом (реакция Зёренсона):
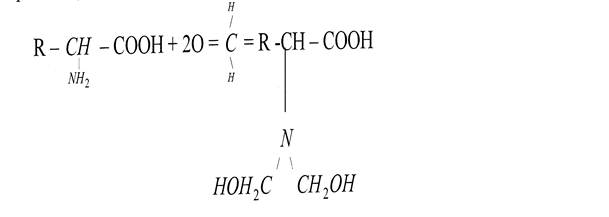
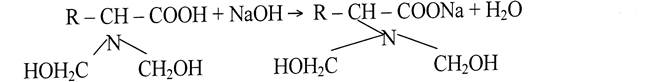
При этом аминогруппа блокируется гидроксиметиленовой группой и теряет свои основные свойства, сохраняя кислотные свойства аминокислоты, которую затем можно оттитровать раствором щелочи. Эта реакция нашла применение при количественном определении по методу формольного титрования аминокислот:
Для идентификации и количественного анализа аминокислот широкое применение получила цветная реакция с нингидрином:
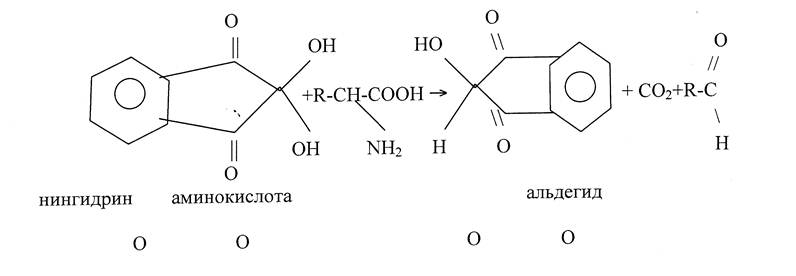
При рН 5,5 и нагревании с избытком нингидрина аминокислота дегидрируется, декарбоксилируется с образованием СО2, NНз, альдегида, а шнгидрин превращается в восстановленный нингидрин. Нингидрин, восстановленный нингидрин и аммиак затем конденсируются с образованием окрашенного соединения. Интенсивность окраски определяется фотоколориметрическим методом анализа, в основе которого лежит способ построения градуировочного графика.
Аминокислоты в белковых гидролизатах предварительно разделяют бумажной, ионообменной хроматографией или электрофорезом. Известен большной ряд реакций, лежащих в основе методов определения аминокислот: шуретовая, ксантопротеиновая, нитропруссидная, реакции Паули, Адамкевича и Вуазене, Сакагучи и др.
В таблице 5 по результатам анализа приведена расшифровка аминокислот белков муки.
Большое внимание уделяется определению общего содержания белка в пищевых объектах. Обычно определение проводят с использованием методе Къельдаля. Он основан на мокром сжигании материала в серной кислоте с использованием катализаторов: Nа2SO4, СuSО4, Sе, Н2О2. В результате выделяющийся аммиак вступает в реакцию с серной кислотой:
2NН3 + Н2SО4 = (NН4)2SО4
Затем проводят отгонку NНз:
(NН4)2SО4+ 2NаОН = 2NН3 + Nа2SO4 + 2Н2О
Аммиак поглощают избытком 0,1 н раствора Н2SО4 и титруют избыток Н2SО4, 1 н раствором NаОН в присутствии фенолфталеина:
Н2SО4 + NаОН = Nа2SO4 + Н2О
Таблица 5 Аминокислотный состав белков муки (в г на 100 г белка)
| Аминокислота | Яровая рожь | Твердая пшеница |
| Лизин | 3,49 | 2,29 |
| Гистидин | 2,14 | 2,37 |
| Аргинин | 4,55 | 3,64 |
| Аспарагиновая кислота | 6,82 | 4,62 |
| Треонин | 3,26 | 2,82 |
| Серии | 4,11 | 4,37 |
| Глутаминовая кислота | 30,51 | 35,78 |
| Пролин | 15,29 | 13,92 |
| Глицин | 3,82 | 3,52 |
| Алании | 4,06 | 3,27 |
| Цистин | 2,65 | 2,66 |
| Валин | 5,22 | 4,77 |
| Метионин | 2,15 | 2,14 |
| Изолейцин | 4,21 | 4,51 |
| Лейцин | 6,65 | 7,46 |
| Тирозин | 2,16 | 2,67 |
| Фенилаланин | 5,16 | 5,48 |
| Аммиак | 3,40 | 3,91 |
Рассчитывают содержание азота в %.
Для перевода количества азота в содержание белка используют коэффициент 6,25. Принят он потому, что большинство белков содержат 16% азота (100:16 = 6,25).
Для пшеницы получен коэффициент 5,7, т.к. ее белки содержат 17,5% азота. Для ржи, ячменя, овса, семян подсолнечника также 5,7; сои - 5,8; кукурузы - 6,25; молока - 6,38 и т.д.
По методу Къельдаля созданывысокопроизводительные, модифицированные, автоматические анализаторы типа «Къельфос».
Имеются и другие методы определения азота, такие как Дюма, нейтронно-активационный, с фенолятгипохлоритом на приборе «Техникон». Метод Дюма включается в разложении органического соединения в атмосфере оксида углерода до газообразного состояния с последующим измерением объема азота (N2). В нейтронно-активационном методе атомы азота анализируемого образца бомбардируются нейтронами в ядерном реакторе с получением изотопа 13N. Содержание белка рассчитывается по количеству гамма-лучей. Определение азота на приборе «Техникон» осуществляется фотоколориметрическим способом. Измеряется интенсивность сине-голубой окраски, образующейся в процессе минерализации образца с щелочным раствором фенола и гипохлорита. Широкое распространение получил метод-инфракрасной спектроскопии, в основе которого лежит поглощение белками света с определенной длиной волны и измерение интенсивности его отражения в специальных приборах-анализаторах.
Известен нефелонометрический метод определения белка, основанный на различной степени помутнения.
Рефрактометрические методы основаны на способности белков адсорбировать красители (кумасси синий R-250, амидочерный и др.) и преломлять лучи света.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 1287; Нарушение авторских прав?; Мы поможем в написании вашей работы!