
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Укажіть, який із зазначених елементів – Карбон чи Флуор – характеризується найбільшою електронегативністю
|
|
|
|
Потенціал йонізації (Ійон) – це найменший потенціал, необхідний для віддалення електрона на безмежну відстань від ядра. Потенціал та енергія йонізації мають спільне співвідношення:
Ейон= 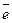 Ійон,
Ійон,
де 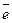 – заряд електрона (1,6·10-19Кл).У періодах простежується наступна тенденція: із збільшенням порядкового номеру елементу потенціал йонізації зростає, що пояснюється зменшенням радіусів атомів. Наприклад, у елементів ІІ періоду потенціал йонізації зростає від Літію (5,39 еВ) до Неону (21,56 еВ). Енергія (потенціал) йонізації зменшується періодично, залежно від порядкового номеру елементу. Найменшими величинами Ейон характеризуються s-елементи І групи, які є найсильнішими відновниками. У межах декад d-елементів значення енергії йонізації поступово збільшується. Таким чином, значення енергії йонізації характеризує відновні властивості атомів.
– заряд електрона (1,6·10-19Кл).У періодах простежується наступна тенденція: із збільшенням порядкового номеру елементу потенціал йонізації зростає, що пояснюється зменшенням радіусів атомів. Наприклад, у елементів ІІ періоду потенціал йонізації зростає від Літію (5,39 еВ) до Неону (21,56 еВ). Енергія (потенціал) йонізації зменшується періодично, залежно від порядкового номеру елементу. Найменшими величинами Ейон характеризуються s-елементи І групи, які є найсильнішими відновниками. У межах декад d-елементів значення енергії йонізації поступово збільшується. Таким чином, значення енергії йонізації характеризує відновні властивості атомів.
Спорідненість до електрона характеризує енергетичний ефект процесу приєднання електрона до нейтрального атома або молекули, що відбувається з утворенням аніону:
Е0 + 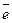 → Е- ± Ɛ,
→ Е- ± Ɛ,
де Ɛ – спорідненість до електрона. Спорідненість до електрона в підгрупах періодичної системи зверху вниз зменшується. В періодах спостерігається більш складна її зміна. Найбільшу спорідненість до електрону мають р-елементи сьомої групи, яким до завершення енергетичного рівня не вистачає одного електрону. Найменшу спорідненість мають р-елементи восьмої групи та атоми хімічних елементів з електронною конфігурацією s2 (Be, Mg, Zn). Вимірюється спорідненість до електрону в тих самих одиницях, що і енергія йонізації (Дж/моль або в електрон-вольтах (еВ/атом).
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 1310; Нарушение авторских прав?; Мы поможем в написании вашей работы!