
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
А- - анионы соли
|
|
|
|
Стандартные электродные потенциалы j0 некоторых металлов
| Электрод | j0, В | Электрод | j0, В |
| Li+/Li | -3,05 | Cd2+/Cd | -0,40 |
| Rb+/Rb | -2,93 | Co2+/Co | -0,28 |
| K+/K | -2,92 | Ni2+/Ni | -0,25 |
| Ba2+/Ba | -2,90 | Sn2+/Sn | -0,136 |
| Ca2+/Ca | -2,87 | Pb2+/Pb | -0,127 |
| Na+/Na | -2,71 | 2H+/H2 | 0,00 |
| Mg2+/Mg | -2,37 | Sb3+/Sb | +0,20 |
| Al3+/Al | -1,70 | Bi3+/Bi | +0,22 |
| Ti2+/Ti | -1,60 | Cu2+/Cu | +0,34 |
| V2+/V | -1,18 | Ag+/Ag | +0,80 |
| Mn2+/Mn | -1,18 | Hg2+/Hg | +0,85 |
| Zn2+/Zn | -0,76 | Pt2+/Pt | +1,19 |
| Cr3+/Cr | -0,74 | Au3+/Au | +1,50 |
| Fe2+/Fe | -0,44 |
|
 |
|
|
|
Электродный процесс (31) Электродный процесс (32) или (33)
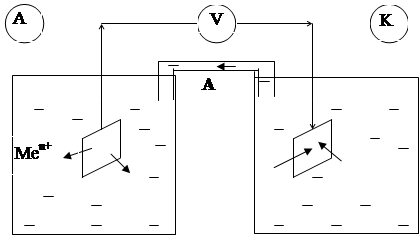
Рис. 2. Схема работы гальванического элемента
Электродвижущая сила Е характеризует способность гальванического элемента совершать электрическую работу:
Е = j К - j А (34)
Электрическая работа определяется максимально полезной работой, совершаемой химической реакцией, которая равна изменению изобарно-изотермического потенциала D G:
D G = - nFE, (35)
где n – число электронов.
Известно, что при самопроизвольном процессе DG <0, поэтому величина Е должна быть больше нуля Е >0 и j К > j А.
Величина 
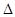 G связана с константой равновесия реакции соотношениями:
G связана с константой равновесия реакции соотношениями:

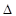 G =- RT ln K равн (36)
G =- RT ln K равн (36)

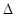 G =-2,3 RT lg K равн, (37)
G =-2,3 RT lg K равн, (37)
где R – универсальная газовая постоянная, R = 8,31 Дж/моль·К;
Т – температура.
Гальванические элементы являются первичными (однократно используемыми) химическими источниками тока (ХИТ). Вторичными (многократно используемыми) ХИТ являются аккумуляторы. Процессы, протекающие при зарядке и разрядке аккумуляторов, взаимообратны.
Гальванические элементы, у которых электроды выполнены из одного и того же металла и опущены в раствор своих солей разной концентрации, называются концентрационными. Функцию анода в таких элементах выполняет металл, опущенный в раствор соли с меньшей концентрацией, например:


А Zn | ZnSO4|| ZnSO4| Zn K
C1 < C2
Пример 1. Составьте схему гальванического элемента, в основе работы которого лежит следующая реакция: Mg + ZnSO4 «MgSO4 + Zn. Что является катодом и анодом в этом элементе? Напишите уравнения процессов, протекающих на электродах. Рассчитайте ЭДС элемента при стандартных условиях (Т=298 К) и определите, в каком направлении реакция протекает самопроизвольно. Вычислите константу равновесия для токообразующей реакции.

 Решение. В таблице находим значения стандартных электродных потенциалов систем Zn/Zn2+ и Mg/Mg2+: j0Zn/Zn2+= -0,76 B, j0Mg/Mg2+= -2,37 B.Поскольку j0Mg/Mg2+<j0Zn/Zn2+,то магниевый электрод является анодом, а цинковый катодом. Схема гальванического элемента имеет вид:
Решение. В таблице находим значения стандартных электродных потенциалов систем Zn/Zn2+ и Mg/Mg2+: j0Zn/Zn2+= -0,76 B, j0Mg/Mg2+= -2,37 B.Поскольку j0Mg/Mg2+<j0Zn/Zn2+,то магниевый электрод является анодом, а цинковый катодом. Схема гальванического элемента имеет вид:
А Mg | MgSO4 || ZnSO4 | Zn K
 На аноде идет процесс окисления:
На аноде идет процесс окисления:
А Mg – 2ē ® Mg2+
 На катоде – восстановление катионов среды:
На катоде – восстановление катионов среды:
К Zn2++2ē ® Zn
ЭДС гальванического элемента Е = jК - jА = -0,76-(-2,37) = 1,61 В.
Величина 
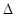 Е >0,следовательно, реакция протекает самопроизвольно в прямом направлении. По уравнению (37) вычисляем константу равновесия токообразующей реакции:
Е >0,следовательно, реакция протекает самопроизвольно в прямом направлении. По уравнению (37) вычисляем константу равновесия токообразующей реакции:
lg K равн.= 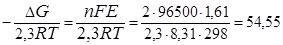 .
.
Потенциируя это уравнение, находим К = 3,5·1054. Поскольку К >> 1, то суммарная реакция протекает самопроизвольно в прямом направлении и практически необратима.
Пример 2. Составьте схему гальванического элемента, состоящего из цинкового и серебряного электродов, погруженных в растворы их солей с концентрациями ионов: СZn2+ = 0,1 моль/л, СAg+ = 0,01 моль/л. Укажите катод и анод. Напишите уравнения реакций, протекающих на данных электродах, а также суммарное уравнение реакции в гальваническом элементе. Рассчитайте ЭДС элемента.
Решение. Так как концентрации ионов не равны единице, то вначале рассчитаем потенциалы электродов, используя формулу Нернста. Если в условии задачи отсутствуют значения температуры, то её принимают равной стандартной температуре Т = 298 К. Поэтому будем использовать уравнение (30):
j = j 0 + 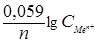 .
.
Подставим числовые значения в эту формулу, используя данные табл. 6:
j Zn/Zn2+= -0,76 + 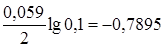 B,
B,
j Ag/Ag+= 0,80 + 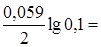 0,741 B.
0,741 B.
Из расчета видно, что jZn/Zn2+< jAg/Ag+.Поэтому цинковый электрод является анодом, а серебряный – катодом.

 Схема гальванического элемента:
Схема гальванического элемента:
A Zn | Zn2+ || Ag+ | Ag K
Вычислим ЭДС элемента по формуле (34):
E= jК - jА = 0,741 – (-0,789) = 1,530 B
Теперь запишем электродные реакции.
 На аноде идет процесс окисления:
На аноде идет процесс окисления:
А Zn – 2ē ® Zn2+,
 а на катоде – восстановления:
а на катоде – восстановления:
К 2Ag+ + 2 ē ® 2Ag.
Складывая уравнения электродных процессов (с учетом числа принимаемых и отдаваемых электронов), получаем суммарное уравнение реакции:
Zn + 2Ag+ ® Zn2+ + 2Ag.
ЗАДАЧИ
161-164. Напишите уравнения катодного и анодного процессов и составьте схему гальванического элемента, при работе которого протекает следующая реакция (см. номер задачи). На основании стандартных электродных потенциалов рассчитайте константу равновесия данной реакции и ЭДС элемента.
| № задачи | Реакция | Ответы |
| Zn + CuSO4 = ZnSO4 + Cu | Кр = 2,5·1037; Е = 1,103 В. | |
| Sn + PbCl2 = SnCl2 + Pb | Кр = 2; Е = 9·10-3 В. | |
| Zn + Pb(NO3)2 = Zn(NO3)2 + Pb | Кр = 3,5·1021; Е = 0,636 В. | |
| Zn + CdSO4 = ZnSO4 + Cd | Кр = 1,56·1012; Е = 0,36 В. |
165-169. Постройте график зависимости ЭДС гальванического элемента от логарифма концентрации ионов металла одного из электродов в растворе:
а) 10; б) 1; в) 0,1; г) 0,01; д) 0,001 моль/л, считая концентрацию ионов другого металла постоянной и равной CMe,2. Напишите уравнение суммарной реакции, протекающей в гальваническом элементе. При каких концентрациях ионов элемент работает за счет протекания реакции в прямом направлении?
Ме1 – анод; Ме2 – катод.
| № задачи | Гальванический элемент | СМе,2, моль/л |
| Sn | Sn2+ || Pb2+ | Pb | 0,1 | |
| Al | Al3+ || Fe2+ | Fe | ||
| Cd | Cd2+|| Ni2+ | Ni | 10-3 | |
| Ni | Ni2+ || Cu2+ | Cu | ||
| Fe | Fe2+ || Sn2+ | Sn | 0,1 |
170-173. Запишите уравнения электродных реакций и составьте схему гальванического элемента, работа которого выражается уравнением, представленным в таблице. Рассчитайте его ЭДС при Т = 298 К и концентрациях солей С 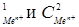 , в растворы которых опущены электроды. Сделайте вывод о том, в каком направлении возможно самопроизвольное протекание реакции.
, в растворы которых опущены электроды. Сделайте вывод о том, в каком направлении возможно самопроизвольное протекание реакции.
Ме1 – анод, Ме2 – катод.
| № задачи | Реакция | С 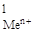 , моль/л , моль/л
| С 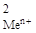 , моль/л , моль/л
| Ответы |
| Fe + 2Ag+ « 2Ag + Fe2+ | 0,01 | 0,1 | 1,24 | |
| Ni + Cu2+ « Ni2+ + Cu | 0,1 | 0,1 | 0,59 | |
| Mg + Pb2+ « Mg2+ + Pb | 0,01 | 2,184 | ||
| Zn + Ni2+ « Ni + Zn2+ | 0,01 | 0,01 | 0,513 |
174-177. Составьте схему гальванического элемента, состоящего из металлов Ме1 и Ме2, погруженных в растворы их солей при концентрациях С 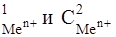 , указанных в таблице. Напишите электронные уравнения катодных и анодных процессов. Рассчитайте ЭДС элемента. Изменится ли величина ЭДС, если концентрацию каждого из ионов понизить в 10 раз?
, указанных в таблице. Напишите электронные уравнения катодных и анодных процессов. Рассчитайте ЭДС элемента. Изменится ли величина ЭДС, если концентрацию каждого из ионов понизить в 10 раз?
| № задачи | Ме1 | Ме2 | С 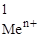 , моль/л , моль/л
| С 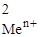 , моль/л , моль/л
| Ответы |
| Zn | Ni | 0,01 | 0,01 | 0,513 В | |
| Fe | Cu | 0,1 | 0,01 | 0,750 В | |
| Fe | Ag | 0,001 | 0,01 | 1,210 В | |
| Mg | Fe | 0,01 | 1,99 В |
178. Какой гальванический элемент называется концентрационным? Составьте схему, напишите уравнениякатодного и анодного процессов, вычислите ЭДС гальванического элемента, состоящего из серебряных электродов, опущенных: первый - в 0,01 М, второй – в 0,1 М растворы AgNO3.
Ответ: 0,059 В.
179. Составьте схемы двух гальванических элементов, в одном из которых никель был бы катодом, а в другом – анодом.Напишите для каждого из этих элементов уравнения реакций, протекающих на катоде и аноде,рассчитайте их ЭДС при стандартных условиях. Изменится ли ЭДС, если концентрацию каждого из ионов уменьшить в 10 раз?
180. Железная и серебрянаяпластины соединены внешним проводником и погружены в раствор серной кислоты. Составьте схему данного гальванического элемента и напишите электронные уравнения процессов, происходящих на катоде и аноде.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 529; Нарушение авторских прав?; Мы поможем в написании вашей работы!