
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электролиз
|
|
|
|
Электролизом называется окислительно-восстановительная реакция, которая протекает на электродах при пропускании через раствор или расплав электролита электрического тока.
При этом катод электролизёра подключается к отрицательному полюсу источника тока, анод - к положительному. Аноды, используемые при электролизе, подразделяются на инертные (графит, уголь, Рt, Аu, Jr)и активные, или растворимые (все остальные металлы). Активные анодырастворяются в первую очередь в ходе электролиза: Ме0 – nē = Men+.
При электролизе с инертным анодом в первую очередь окисляются простые ионы (I-, Br-, Cl-,OH-).Если таких ионов в растворе нет, то тогда окисляются молекулы воды: 2 H2O - 4ē = O2 + 4H+. Сложные ионы (SO  и др.) из водных растворов не окисляются – вместо них окисляется вода.
и др.) из водных растворов не окисляются – вместо них окисляется вода.
Последовательность процессов окисления на аноде можно представить следующей схемой:
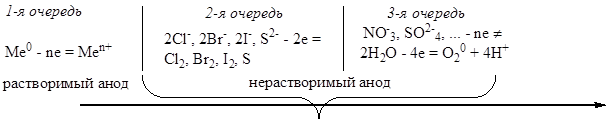
На катоде более легко восстанавливаются частицы с наибольшим электродным потенциалом. Продукты восстановления определяются величиной стандартного электродного потенциала металла. Последовательность разряда на катоде в водной среде можно представить следующей схемой:
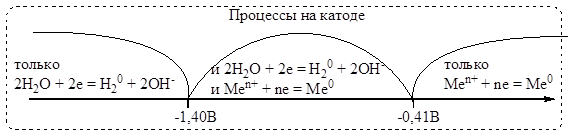
В соответствии с этой схемой из водных растворов восстанавливаются только те металлы, у которых электродный потенциал jMe/Men+>jH2O= -0,41 B.
Активное разложение воды происходит при потенциале металла jMe/Men+< -1,4 B.Как видно из рисунка, существует зона конкурирующих процессов (-1,4 B < jMe/Men+ < -0,41 B).
В расплавах молекулы воды отсутствуют. Поэтому на катоде и аноде протекают процессы с участием только ионов расплава.
Пример 1. Составьте электронные уравнения катодных и анодных процессов, протекающих при электролизе раствора K2SO4 с графитовыми электродами.
Решение. В водном растворе сульфат калия K2SO4 диссоциирует на ионы:
K2SO4 «2K+ + SO42-
К катоду подходят катионы К+ и H2O, к аноду – анионы SO42- и Н2О. Поскольку потенциал системы jк/к+ = -2,924 В (табл. 6, с. 49) меньше, чем –1,4, то на катоде будут восстанавливаться частицы воды (см. схему).
Анионы SO42- - это сложные ионы, и в водных растворах они не окисляются, поэтому на аноде разряжаются молекулы воды:
 - К: К+, Н2О 2 Н2О + 2ē ® 2OH- + H2 – восстановление
- К: К+, Н2О 2 Н2О + 2ē ® 2OH- + H2 – восстановление
+А: SO42-, H2O 2 Н2О – 4ē ® 4 H+ + O2 – окисление
Раствор у катода подщелачивается (ионы ОН-), у анода – становится более кислым (ионы Н+).
Суммарное уравнение реакции:
K2SO4 + 4Н2О  2Н2+ 2 КОН + H2SO4 + O2
2Н2+ 2 КОН + H2SO4 + O2
KOH и H2SO4 образуются из ионов К+ и ОН-, Н+ и SO42 -, находящихся в растворе.
Пример 2. Составьте электронные уравнения катодных и анодных процессов, протекающих при электролизе раствора CuCl2 с медным анодом.
Решение. Уравнение диссоциации соли имеет вид:
CuCl2 «Cu2+ + 2Cl-
К катоду подходят катионы Cu2+ и H2O;к аноду – ионы Cl- и H2O. Медный анод – растворимый, он принимает участие в электродной реакции. Потенциал меди составляет j0Cu/Cu2+ = 0,34 B, т.е. jCu/Cu2+>j 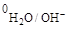 = –0,41 B. На катоде в соответствии с приведенной схемой будут восстанавливаться катионы Cu2+. В анодном процессе окисляется материал анода.
= –0,41 B. На катоде в соответствии с приведенной схемой будут восстанавливаться катионы Cu2+. В анодном процессе окисляется материал анода.
 - К: Cu2+, H2O Cu2+ + 2ē ® Cu
- К: Cu2+, H2O Cu2+ + 2ē ® Cu
+A: Cl-, H2O, Cu Cu - 2ē ® Cu2+
В ряде случаев путем изменения концентрации ионов соли можно изменить величину потенциала разряда иона и в соответствии с приведенной схемой уменьшить скорость разряда молекул воды.
Это необходимо учитывать при практическом использовании электролиза. Минимальный потенциал, при котором процесс электролиза становится возможным, называется потенциалом (напряжением) разложения Е р вещества. Его теоретическую величину находят как разность электродных потенциалов для процессов, происходящих на электродах:
Е р = jА - jк. (42)
Количественная характеристика процессов электролиза даётся законами Фарадея. Им можно дать следующую общую формулировку:
Масса электролита, подвергшаяся превращению при электролизе, а также массы образующихся на электродах веществ прямо пропорциональны количеству электричества, прошедшего через раствор или расплав электролита, и эквивалентным массам соответствующих веществ.
Закон Фарадея выражается следующим уравнением:
 , (43)
, (43)
где А – атомная масса вещества;
n – заряд иона;
I – сила тока, А;
t – время пропускания тока, с.
Эквивалентная масса вещества Э = 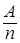 . Поскольку обычно имеются конкурирующие процессы, законы Фарадея нуждаются в поправках.
. Поскольку обычно имеются конкурирующие процессы, законы Фарадея нуждаются в поправках.
Отношение массы фактически выделившегося на электроде вещества m пр. к массе вещества, которая должна была выделиться в соответствии с законом Фарадея, называется выходом по току h:
h = 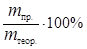 . (44)
. (44)
Пример 3 Электрический ток силой 1 А проходит в течение 1 часа через раствор ZnCl2 (электроды инертные). Определите количество выделившегося на катоде за указанное время цинка, если выход по току hравен 64%. Объясните, на какие процессы расходуется остальной ток.
Решение. Потенциал jZn0/Zn2+ = -0.76 B (см. табл. 5) и лежит в области –1,4 В <j < -0,41 В. Следовательно, на катоде будет идти совместный разряд Zn2+ и молекул воды:
Zn2+ + 2ē ® Zn
частично: 2H2O + 2ē ® 2OH- + H2
Для определения количества выделившегося на катоде цинка воспользуемся уравнением закона Фарадея:
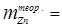

Выход по току h =  ;
;
отсюда
m пр = 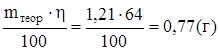 .
.
На получение цинка на катоде расходуется 64% всего прошедшего через электролит тока, остальной ток тратится на восстановление воды.
ЗАДАЧИ
201-205. Составьте электронные уравнения процессов, протекающих на катоде и аноде при электролизе расплава А, растворов Б и В (формулы веществ см. в табл.). В случае соединений А и Б использовались инертные электроды, а при электролизе В – растворимый анод. Масса твердого вещества, выделившегося на катоде при электролизе раствора Б при прохождении тока I, А в течение t часов, составляет m, г. Вычислите выход по току.
Объясните, почему в ряде случаев не весь ток расходуется на выделение металла.
| № задачи | Соединения | Растворимый анод | I, A | t, ч | m, г | Ответы, % | ||
| А | Б | В | ||||||
| KCl | SnCl2 | ZnSO4 | Zn | 8,5 | 36,6 | |||
| FeCl2 | ZnSO4 | MgCl2 | Mg | 1,5 | 11,3 | |||
| NaOH | FeCl2 | MnSO4 | Mn | 0,5 | 4,2 | |||
| PbCl2 | Cu(NO3)2 | FeCl2 | Fe | 7,1 | ||||
| Ca(OH)2 | NiCl2 | AlCl3 | Al | 9,3 | 18,8 | 91,1 |
206-210. Составьте электронные уравнения процессов, протекающих на катоде и аноде при электролизе расплава А, растворов Б и В (формулы веществ см. в табл.). В случае соединений А и Б использовались инертные электроды, соединения В – растворимый анод.
Вычислите время, необходимое для получения электролизом 100 г металла из раствора Б при силе тока I, A, если выход по току h.
| № задачи | Соединения | Растворимый анод | I, A | h, % | Ответы, ч. | ||
| А | Б | В | |||||
| SnCl2 | Fe(NO3)2 | NiSO4 | Ni | 66,7 | |||
| Ni(OH)2 | CoCl2 | Pb(NO3)2 | Pb | 9,5 | |||
| MgCl2 | NiSO4 | ZnSO4 | Zn | 6,4 | 17,3 | ||
| ZnCl2 | AgNO3 | CuCl2 | Cu | 14,8 | 1,7 | ||
| CuBr2 | Cd(NO3)2 | AgNO3 | Ag | 8,7 | 6,4 |
211-215. Составьте электронные уравнения процессов, протекающих на катоде и аноде при электролизе расплава А, растворов Б и В (формулы веществ см. в табл.). В случае соединений А и Б использовались инертные электроды, соединения В – растворимый анод. Как изменится масса анода после пропускания тока силой I, A в течение времени t, ч через раствор В.
| № задачи | Соединения | Растворимый анод | I, A | t, ч | Ответы, г | ||
| А | Б | В | |||||
| NaJ | MgSO4 | ZnCl2 | Zn | 8,5 | 20,6 | ||
| CaCl2 | Cu(NO3)2 | FeCl2 | Fe | 31,3 | |||
| RbCl | AgNO3 | CuSO4 | Cu | 7,5 | 2,5 | 22,4 | |
| KOH | ZnCl2 | CoCl2 | Co | 3,7 | 4,1 | ||
| CuCl2 | NaNO3 | Pb(NO3)2 | Pb | 2,5 | 38,6 |
216-220. Составьте электронные уравнения процессов, протекающих на катоде и аноде при электролизе расплава А, растворов Б и В(формулы веществ см. в табл.). В случае соединений А и Б использовались инертные электроды, соединения В – растворимый анод.
Сколько граммов кислоты образуется возле анода при электролизе раствора Б, если на аноде выделилось 1,12 л кислорода, измеренного при н.у.?
Вычислите массу вещества, выделяющегося на катоде.
| № задачи | Соединения | Растворимый анод | Ответы, г | ||
| А | Б | В | |||
| KOH | Na2SO4 | NiCl2 | Ni | 4,9; 0,2 | |
| RbCl | Li2SO4 | Pb(NO3)2 | Pb | 4,9; 0,2 | |
| NaCl | Ni(NO3)2 | AgNO3 | Ag | 12,6; 5,9 | |
| AlCl3 | Fe2(SO4)3 | CuSO4 | Cu | 9,8; 3,7 | |
| NaJ | Cu(NO3)2 | ZnCl2 | Zn | 12,6; 6,4 |
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 936; Нарушение авторских прав?; Мы поможем в написании вашей работы!