
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Коррозия металлов
|
|
|
|
Коррозия – самопроизвольное разрушение металлов в результатевзаимодействия с окружающей средой.
По механизму протекания коррозия подразделяется на химическую и электрохимическую. Химическая коррозия протекает в газовой среде при повышенных температурах (в отсутствии влаги) или в жидких неэлектролитах. Сущность процессов коррозии этого вида сводится к окислительно-восстановительной реакции, осуществляемой непосредственным переходом электронов металла на окислитель. В качестве окислителя могут выступать такие газы, как O2 , SO2, Cl2, HCl и др. Коррозии способствуют также H2S, CO2. В результате реакции на поверхности металла образуются пленки оксидов, сульфидов, хлоридов и т.д. Развитие коррозии происходит за счет переноса катионов металла и частиц окислителя через эту пленку во встречных направлениях. Если образуется плотная сплошная, хорошо сцепленная с металлом пленка, то дальнейшее окисление металла протекает очень медленно. Такие пленки могут быть использованы для защиты металлов от коррозии. Напротив, пористая рыхлая пленка не способна защищать металл от взаимодействия с окружающей средой.
Качество пленки определяется на основании расчета фактора рыхлости П:
 , (38)
, (38)
где V oк – молярный объем продуктов коррозии;
r ок – их плотность;
V Me – молярный объем металла;
М – молярная масса продукта коррозии (оксида, сульфида, хлорида и т.д.);
А – атомная масса металла;
r Ме – плотность металла;
n – число атомов металла в молекуле оксида, сульфида и др.
Если П <1, то образуется плёнка, частично покрывающая поверхность металла (рыхлая пленка).
Сплошные плёнки получаются при условии 1< П <2,5.
Если фактор рыхлости П >2,5,то в плёнке возникают напряжения, разрушающие ее и нарушающие сплошность (плёнка растрескивается).
Пример 1. При химической коррозии железа в атмосфере сухого воздуха, содержащего газообразные Cl2, H2S и O2, образуются пленки FeS, FeO, FeCl2. Напишите уравнения образования этих соединений. Рассчитайте фактор рыхлости П и сделайте вывод о защитных свойствах плёнок. Плотности r Fe = 7,87; r FeS = 4,7; r FeО = 5,7; rFeCl  = 2,9 г/см3.
= 2,9 г/см3.
Решение. Плёнки образуются при взаимодействии с агрессивной средой в результате следующих реакций:
2Fe + 2H2S + O2 ® 2FeS + 2H2O
2Fe + O2 ® 2FeO
Fe + Cl2 ® FeCl2
Находим значения фактора рыхлости П:
ПFeS =  Fe0 =
Fe0 =  ;
;
ПFeCl  =
=  .
.
Поскольку для сульфидной и хлоридной пленок П > 2,5, то возможно их растрескивание и нарушение сплошности. Критерий П для оксидной пленки лежит в интервале 1 < П Fe0 < 2,5. Следовательно, пленка FeO является сплошной и обладает хорошими защитными свойствами.
Электрохимическая коррозия – самопроизвольное разрушение металлов в присутствии электролитов (жидких или расплавленных веществ, проводящих электрический ток) в результате образования микрогальванических элементов.
При электрохимической коррозии процессы окисления и восстановления протекают на участках, имеющих различные значения электродных потенциалов j.
На анодных участках, имеющих меньшее значение j, происходит окисление металла:
 А Me – nē ® Men+
А Me – nē ® Men+
При этом электроны внутри металла перемещаются к катодным участкам, на которых происходит восстановление ионов или молекул из коррозионной среды. В зависимости от состава среды возможны следующие процессы:
 в кислой среде:
в кислой среде:
К 2Н+ + 2ē = Н2;
 в нейтральной или слабощелочной среде:
в нейтральной или слабощелочной среде:
К 2Н2О + 2ē = Н2 + 2ОН-.
Наиболее вероятным катодным процессом при наличии растворенного в воде воздуха является следующий:

К О2 + 2Н2О + 4ē = 4ОН-.
Пример 2. Составьте электронные уравнения катодного и анодного процессов коррозии железа с примесью никеля в а) соляной кислоте и б) влажном воздухе. Каков состав продуктов коррозии?
Решение. Выпишем стандартные электродные потенциалы металлов: j0 Fe/Fe2+ = -0,44 В;
j0Ni/Ni2+ = -0,25 В.
Поскольку j0Fe/Fe2+ < j0Ni/Ni2+, железо выполняет функциюанода,а никель – катода.
 а) В кислой среде электронные уравнения процессов имеют вид:
а) В кислой среде электронные уравнения процессов имеют вид:
АFe – 2ē ® Fe2+ – анодное окисление;

К 2Н+ + 2ē ® Н2 –катодное восстановление.
Продуктами коррозии являются хлорид железа FeCl2 и водород.
б) Во влажном воздухе на катодном и анодном участках происходят следующие реакции:
 А Fe - 2ē ® Fe2+,
А Fe - 2ē ® Fe2+,

К О2 + 2Н2О + 4ē ® 4ОН-;
Продукт коррозии: Fe2+ + 2OH- ® Fe(OH)2.
В присутствии влаги и кислорода происходит дальнейшее окисление железа до трехвалентного состояния:
4 Fe(OH)2 + 2H2O + O2 = 4 Fe (OH)3.
Для количественной оценки коррозионной стойкости металлов используют массовые (j) и линейные (П) показатели.
Скорость коррозии j определяется:
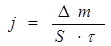 (г/м2·час или г/м2·год), (39)
(г/м2·час или г/м2·год), (39)
где D m – изменение массы образца, г, при коррозии металла в течение времени t, час (или год) на поверхности S, м2.
Глубинный показатель коррозии П равен:
П =  (мм/год), (40)
(мм/год), (40)
где D h – толщина металла, мм, разрушенного в течение времени t, год.
Величины П и j связаны соотношением:
П = 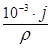 , если j измеряется в г/м2·год;
, если j измеряется в г/м2·год;
или П = 8,76 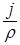 , если j измеряется в г/м2·час;
, если j измеряется в г/м2·час;
где r – плотность металла, г/см3.
Защита металлов от коррозии
Защита металлов от коррозии в основном осуществляется путем создания изолирующих плёнок или ингибирующих покрытий, а также электрохимическими методами (включая гальванические покрытия).

 Металлические покрытия делятся на катодные и анодные в зависимости от соотношения электродных потенциалов j защищаемого изделия (Ме1) и покрытия (Ме2).
Металлические покрытия делятся на катодные и анодные в зависимости от соотношения электродных потенциалов j защищаемого изделия (Ме1) и покрытия (Ме2).









































 А К
А К















 Ме2 Ме2
Ме2 Ме2


Ме1 К Ме1 А
а) б)
Рис. 3. Анодное а) и катодное б) покрытия
При нарушении целостности покрытия оба металла соприкасаются с агрессивной средой, возникает гальванический элемент. Если j1>j2, то Ме2 будет анодом (анодное покрытие), а Ме1 –катодом. Анодное покрытие очень эффективно, т.к., разрушаясь само, оно предохраняет защищаемый металл от разрушения.
Если j1<j2, то при нарушении целостности покрытия, защищаемый металл будет анодом, а металл покрытия - катодом. Катодные покрытия защищают металл до тех пор, пока пленка будет сплошной.
Электрохимическая защита подразделяется на катодную, протекторную и анодную. В коррозионную среду вводят также ингибиторы.
Ингибиторами называются добавленные в раствор вещества, которые накапливаются на границе металл – электролит и снижают скорость коррозии.
Эффективность действия ингибиторов оценивается величинами коэффициента торможения К и степени защиты Z:
 ;
; 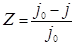 × 100%,(41)
× 100%,(41)
где j 0 – скорость коррозии в растворе без ингибитора,
j – с ингибитором.
Величина К показывает, во сколько раз снижается скорость коррозии металла при введении ингибитора. Z характеризует относительное понижение скорости коррозии.
Пример 3. Можно ли использовать цинковое покрытие для защиты стального изделия от коррозии во влажном воздухе? Составьте электронные уравнения катодного и анодного процессов коррозии, наблюдаемой при нарушении этого покрытия. Каков состав продуктов коррозии? Какой должна быть толщина покрытия, чтобы оно прослужило 5 лет, если величина его глубинного показателя П равна 0,16 мм/год? Покрытие считается недействующим, если его остаточная толщина составляет 18 % от первоначального значения.
Решение. Сопоставляя электродные потенциалы  -0,76 В и
-0,76 В и  -0,44 В, мы видим, что
-0,44 В, мы видим, что  . Следовательно, цинк по отношению к железу будет являться анодом. Цинковое покрытие – анодное. На аноде идет процесс окисления:
. Следовательно, цинк по отношению к железу будет являться анодом. Цинковое покрытие – анодное. На аноде идет процесс окисления:

А Zn - 2ē ® Zn2+.
На катоде (Fe) процесс восстановления частиц среды (во влажном воздухе это кислород и вода):

К О2 + 2Н2О + 4ē = 4ОН-.
Продукт коррозии: Zn2+ + 2OH- ® Zn (OH)2
При нарушении покрытия сталь не растворяется, следовательно, цинковое покрытие использовать можно.
Толщину покрытия D h можно найти из уравнения (40):
П =  , откуда D h = П ×t = 0,16×5=0,8 (мм).
, откуда D h = П ×t = 0,16×5=0,8 (мм).
Но коррозии подвержено 82 % первоначальной толщины. Тогда вся толщина покрытия должна быть равной  .
.
ЗАДАЧИ
181-183. Можно ли использовать предлагаемый материал в качестве протектора для защиты стального изделия от коррозии в природной воде, насыщенной кислородом?
Составьте электронные уравнения катодного и анодного процессов коррозии. Каков состав продуктов коррозии?
Определите возможный срок службы протектора сечением а х× в, если скорость его коррозии j, г/м2×год, а масса m, г.
| № задачи | Материал протектора | а, см | в, см | j, 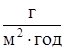
| m, г | Ответы |
| Zn | ||||||
| Al | 2,5 | |||||
| Mg |
184-188. Составьте электронные уравнения анодного и катодного процессов коррозии стального трубопровода, содержащего включение А, во влажной почве (Н2О и О2). Каков состав продуктов коррозии?
Рассчитайте необходимую толщину стенок трубопровода (мм), который должен прослужить tлет, если скорость его коррозии равна j. Остаточная толщина стенок трубопровода должна быть не меньше 25% от первоначального значения. Плотность железа r = 7,87 г/см3.
| № задачи | Примесь А | j, кг/м2·год | t, лет | Ответы, мм |
| Ni | 3,305 | 8,4 | ||
| Sn | 6,558 | 6,67 | ||
| Pb | 4,984 | 5,07 | ||
| Cu | 1,695 | 3,73 | ||
| Sb | 6,690 | 4,53 |
189-192. Можно ли использовать данное покрытие для эффективной защиты стального изделия от коррозии во влажном воздухе?
Составьте электронные уравнения катодного и анодного процессов коррозии, возникающей при нарушении целостности покрытия. Каков состав продуктов коррозии?
Какой должна быть толщина покрытия, чтобы оно прослужило t лет, если величина его глубинного показателя коррозии П, мм/год. Покрытие считается действующим до тех пор, пока его остаточная толщина не составит 15% от первоначального значения.
| № задачи | Металл покрытия | t, лет | П, мм/год | Ответы, мм |
| Mg | 0,7 | 3,3 | ||
| Zn | 0,3 | 1,76 | ||
| Al | 0,6 | 3,53 | ||
| Ti | 0,3 | 4,23 |
193-196. При химической коррозии металлов (Ме) в атмосфере сухого воздуха, содержащего газообразные O2, HCl, H2S, под воздействием высоких температур образуются пленки продуктов коррозии.
Напишите уравнения образования этих соединений.
Зная плотности металлов, их оксидов, хлоридов, сульфидов, определите, какие из плёнок будут обладать защитным действием.
| № задачи | Металл, Ме | rМе, г/см3 | Продукты коррозии и их плотности, г/см3 |
| Fe | 7,87 | FeO – 5,7; Fe2O3 – 5,25; FeCl2 – 2,98; FeS2 – 5,03; Fe3O4 – 5,18. | |
| Cu | 8,94 | CuO – 6,46; Cu2O – 3,7; CuCl2 – 3,05; Cu2S – 5,4; CuS - 4,68. | |
| Mn | 7,44 | MnO – 5,18; Mn2O3 - 4,3; Mn3O4 – 7,42; MnCl2 - 2,98; MnO2 - 5,03. | |
| Ni | 8,91 | NiO - 7,45; Ni2S3 - 5,82; NiCl2 - 3,51; NiS - 4,1. |
197-200. Металлическое изделие, содержащее примесные включения А, сильно корродирует в растворе HCl. Скорость коррозии составляет j 0, г/м2·час. Для замедления процесса в растворах кислот используют ингибиторы. Скорость коррозии изделия в присутствии ингибитора – j. Определите коэффициент торможения коррозии К и степень защиты Z.
Составьте электронные уравнения катодного и анодного процессовкоррозии изделия в кислоте. Каков состав продуктов коррозии?
| № задачи | Металл изделия | Примесь А | j 0 | j | Ответы |
| Fe | Sb | 1,25 | 0,36 | 3,5; 71,2% | |
| Fe | Ni | 1,05 | 0,13 | 8,0; 87,6% | |
| Cd | Sn | 0,45 | 0,14 | 3,2; 68,9% | |
| Zn | Cu | 9,6 | 2,6; 61,6% |
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 1339; Нарушение авторских прав?; Мы поможем в написании вашей работы!