
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Задачи прикладного характера
|
|
|
|
241. Эффективность защитного действия ингибитора определяют по коэффициенту торможения (ингибирования):
g =  ;
;
где uк - скорость коррозии металла в отсутствии ингибитора;
uки - скорость коррозии в присутствии ингибитора.
Скорость коррозии стали в водной среде составляет 9,108 в присутствии ингибитора И-1-А 0,172 и ингибитора АНПО 0,207 г/м2×год. При использовании смеси ингибиторов И-1-А и АНПО (1:1) с той же суммарной концентрацией 0,05 кг/м3 скорость коррозии составляет 0,00134 г/м2×год, т.е. эффективность защиты металла при использовании смеси ингибиторов возрастает.
Вычислите коэффициент ингибирования для каждого случая, считая, что в небольшом диапазоне концентраций коэффициент ингибирования пропорционален концентрации.
242. Зависимость логарифма скорости коррозии железа от концентрации азотной кислоты дана в табл. 6.
Таблица 6
| С,% | |||||||
| lg uкорр. | 3,2 | 3,5 | -1,1 | -1,1 | -1,1 | -1,1 | 0,1 |
 Представьте эти результаты графически. Чем объясняется резкий спад скорости коррозии при концентрации СНNO
Представьте эти результаты графически. Чем объясняется резкий спад скорости коррозии при концентрации СНNO  > 40%? Почему при СНNO
> 40%? Почему при СНNO  >95% коррозия усиливается? Объясните, почему при перевозке НNO3 по железной дороге используются алюминиевые цистерны?
>95% коррозия усиливается? Объясните, почему при перевозке НNO3 по железной дороге используются алюминиевые цистерны?
243. В каком случае металл двигателя внутреннего сгорания в большей степени подвергается коррозионному разрушению: при непрерывной работе или при частых остановках? Составьте уравнения анодного и катодного процессов коррозии стали в кислой среде. Какие продукты коррозии образуются при этом?
244. Почему металл двигателя внутреннего сгорания подвергается значительному коррозионному разрушению при частых остановках двигателя? Когда эти остановки опаснее: в летнее или зимнее время? Почему? Составьте электронные уравнения электрохимической коррозии сплава железа с включениями никеля в кислой среде. Каков состав продуктов коррозии?
245. Стальные цистерны применяют для транспортировки концентрированных серной и азотной кислот. Почему надо закрывать люк в цистернах после освобождения их от кислот? Как протекает коррозия в указанном случае? Что является анодом и что катодом? Составьте электронные уравнения соответствующих процессов.
246. Получение перспективных конструкционных материалов осуществляется металлотермическим методом. При какой температуре начнется реакция:
ТiO2 + 2Н2 ® Тi + 2Н2О?
DН  = -944 кДж/моль; S
= -944 кДж/моль; S 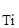 = 30,6; SТiO
= 30,6; SТiO 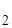 = 50 Дж/моль×К;
= 50 Дж/моль×К;
DН  = -242 кДж/моль; SН
= -242 кДж/моль; SН  = 131; SН
= 131; SН 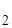 О = 189 Дж/моль×К.
О = 189 Дж/моль×К.
247. Известно, что марганец широко используется в качестве раскислителя стали. Возможно ли получить марганец из МnO2 алюмотермическим методом при Т= 293 К? Ответ подтвердите расчетом реакции.
DН  = -520 кДж/моль; SMn = 32; SMnO
= -520 кДж/моль; SMn = 32; SMnO  = 53 Дж/моль×К;
= 53 Дж/моль×К;
DН  = -1675 кДж/моль; SАl= 28; S
= -1675 кДж/моль; SАl= 28; S 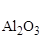 = 51Дж/моль×К.
= 51Дж/моль×К.
248. При коррозии железа в воде происходит следующая реакция:
Fе + Н2О(ж) ® Fe3O4(т) + Н2
Уравняйте. На основании термодинамических расчетов докажите, что эта реакция при Т = 298 К происходит самопроизвольно.
DН  = -286 кДж/моль; DН
= -286 кДж/моль; DН 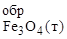 = -1118 кДж/моль;
= -1118 кДж/моль;
SН 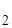 О(ж) = 70; S
О(ж) = 70; S  = 142; SFе = 27; SН
= 142; SFе = 27; SН  = 131 Дж/моль×К.
= 131 Дж/моль×К.
249. Возможна ли совместная перевозка или хранение на складе этилен-гликоля, являющегося основой антифризных составов, и аммиачной селитры? Проведите соответствующие расчеты, зная, что вероятная схема реакции следующая:
С2Н6О2 + 5NН4NO3 ® 5N2 + 2CO2 + 13Н2О
DG  = - 319,45; DG
= - 319,45; DG 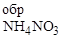 = -183,96;
= -183,96;
DG 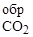
 = -394,64; DG
= -394,64; DG  = -237,4 кДж/моль.
= -237,4 кДж/моль.
250. Как изменится скорость реакции сгорания пропана С3Н8 (используемого в качестве жидкого топлива в карбюраторных двигателях) при увеличении давления вдвое?
251. При получении электротехнической меди на поверхности провода при Т = 1200 К образуется двухслойная окалина, содержащая СuО и Сu2О. Проведите термодинамический анализ реакций, при которых возможно образование этих оксидов:
1) Сu + ½ О2 = СuO; DG1. 2) 2Сu + ½ O2 = Сu2О; DG2
Cравнивая реакции 1 и 2, укажите, какой из оксидов легче образуется на поверхности проволоки? Энтальпии образования Сu2O и СuO равны соответственно –173 и –162 кДж/моль, а энтропии Сu2O, СuO, Сu и О2 равны 92,9; 42,6; 33; 205,4 Дж/моль×К.
252. Основным показателем качества электротехнической меди является содержание в ней кислорода. Ее очистка производится в атмосфере водорода:
Сu2O + Н2 = 2Сu + Н2О
СuO + Н2 = Сu + Н2О
Накапливающаяся в дефектах металла вода оказывает расклинивающее давле-ние, что приводит к образованию микротрещин («водородная болезнь»). Зная, что изобарные потенциалы образования Сu2O, СuO и Н2О равны соответственно –86,3; -129,4; -228,8 кДж/моль, укажите, какой из слоев двухслойной окалины восстанавливается легче?
253. Сплавы типа «победит» содержат карбиды вольфрама, титана и других металлов. Их применение ограничено в связи с высокими температурами, возникающими в зоне трения. При этом возможны два процесса:
1) графитизация карбида 2WC = W2C + C;
2) выгорание углерода 2WС + О2 = W2C + CO2.
На основании термодинамических расчетов оцените возможность протекания каждой из реакций, зная, что локальная температура в зоне резания может достигать 1250 К. Теплоты образования WC, W2C и СО2 равны соответственно –41,0; -26 и –393,5 кДж/моль, а энтропии WC, W2C; С, О2, СО2 равны 36; 82; 5,74; 205,4; 213,68 Дж/моль×К.
254. В качестве антифризной жидкости используется этиленгликоль. Оцените возможность самовозгорания этой жидкости при ее контакте с перекисью водорода. Возможно ли протекание реакции:
С2Н6О2(ж) + 5Н2О2(ж) = 2СО2(г) + 8Н2О (г),
если D G  = -454,5; D G
= -454,5; D G 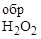 = - 120,4;
= - 120,4;
D G 
 = -228; D G
= -228; D G 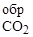 = -394,6 кДж/моль?
= -394,6 кДж/моль?
255. Температура вспышки – самая низкая температура, при которой образующиеся над жидкостью пары способны вспыхивать от источника зажигания. Для простых органических молекул она рассчитывается по формуле:
t всп. = а о + а 1· t кип. + а 2·D Н гор,
где t кип. – температура кипения;
D Н гор – тепловой эффект реакции горения вещества;
а о, а 1 и а 2 – эмпирические константы.
Вычислите температуру вспышки этиленгликоля, если tкип. = 197,6оС.
D Н  = - 389,4; D Н
= - 389,4; D Н 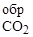 = -393,5; D Н
= -393,5; D Н 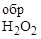 = -242,8 кДж/моль;
= -242,8 кДж/моль;
а о = -45,5; а 1 = 0,83; а 2 = -0,0082.
256. В качестве альтернативного топлива в двигателях внутреннего сгорания грузового тепловоза 2ТЭ10 используется пропиловый спирт. Определите количество тепла, выделяющегося при сгорании 1000 кг пропилового спирта. D Н  = -242; D Н
= -242; D Н 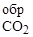 = -393,5; D Н
= -393,5; D Н 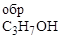 = -307 кДж/моль.
= -307 кДж/моль.
257. Процесс декарбонизации известняка протекает по уравнению:
СаСО3(т) «СаО(т) + СО2(г); DН = 178 кДж/моль.
Сколько тепла нужно затратить на разложение 150 кг известняка, содержащего 8% примесей? Будет ли эта реакция протекать самопроизвольно при стандартных условиях?
D Н 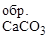 = -1206; S
= -1206; S  = 89 Дж/моль×К;
= 89 Дж/моль×К;
D Н  = -635 кДж/моль; S
= -635 кДж/моль; S  = 40 Дж/моль×К;
= 40 Дж/моль×К;
D Н  = -393 кДж/моль; S
= -393 кДж/моль; S  214 Дж/моль×К.
214 Дж/моль×К.
258. Сколько тепла выделится при твердении 62,5 кг строительного гипса, содержащего 20% примесей, если реакция протекает по уравнению:
СаSO4 · 0,5H2O + 1,5H2O(ж) ® СаSO4 · 2H2O; DНх.р.= -17 кДж/моль.
Возможно ли самопроизвольное протекание реакции при стандартной температуре?
D Н  = -1575 кДж/моль; S
= -1575 кДж/моль; S 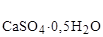 = 131 Дж/моль×К;
= 131 Дж/моль×К;
D Н  = -286 кДж/моль; SН
= -286 кДж/моль; SН 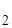 О(ж) = 70 Дж/моль×К;
О(ж) = 70 Дж/моль×К;
D Н 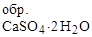 = - 2021 кДж/моль; S
= - 2021 кДж/моль; S 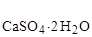 = 194 Дж/моль×К.
= 194 Дж/моль×К.
259. Негашеная известь получается путем прокаливания известняка СаСО3. Вычислите, при какой температуре начнется эта реакция?
D Н 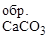 = -1206 кДж/моль; S
= -1206 кДж/моль; S 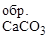 = 89 Дж/моль×К;
= 89 Дж/моль×К;
D Н  = -635 кДж/моль; S
= -635 кДж/моль; S  = 40 Дж/моль×К;
= 40 Дж/моль×К;
D Н  = -393 кДж/моль; S
= -393 кДж/моль; S 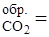 214 Дж/моль×К.
214 Дж/моль×К.
260. Магнезиальная коррозия бетона протекает по уравнению:
Са(ОН)2(т) + МgSO4(т) = СаSO4(т) + Мg(ОН)2(т).
Сделайте вывод о возможности самопроизвольного протекания реакции в стандартных условиях.
D Н 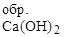 = -996 кДж/моль; S
= -996 кДж/моль; S 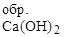 = 83 Дж/моль×К;
= 83 Дж/моль×К;
D Н  = -1277 кДж/моль; S
= -1277 кДж/моль; S  = 92 Дж/моль×К;
= 92 Дж/моль×К;
D Н 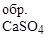
 = -1424 кДж/моль; S
= -1424 кДж/моль; S 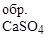 = 107 Дж/моль×К;
= 107 Дж/моль×К;
D Н  = -925 кДж/моль; S
= -925 кДж/моль; S  = 63 Дж/моль×К.
= 63 Дж/моль×К.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 547; Нарушение авторских прав?; Мы поможем в написании вашей работы!