
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электролизер
|
|
|
|
ГЭ
Химиялық энергия ⇆ электр энергиясы
Яғни, ГЭ пен электролиздердің бір-бірінен принциптері бойынша айырмашылығы болады, олар: 1) ГЭ – бұл электр тогының көзі, ал электролизер – электр тогын қолданушы; 2) ГЭ-те химиялық энергия электр энергиясына айналады. Ал, электролизерде керісінше электр энергиясы химиялық энергияға айналады; 3) ГЭ-те электрохимиялық тотығу және тотықсыздану процестері өздігінен жүреді. Ал, электролизерде электрохимиялық тотығу және тотықсыздану процестері тек қана сырттан берілетін электр тогының әсерінен ғана жүреді. Яғни, олар өздігінен жүрмейді; 4) ГЭ-те теріс зарядталған электрод – анод,оң зарядталған электрод – катод. Ал, электролизерде, керісінше, теріс зарядталған – катод, оң зарядталған – анод (14.35-сурет).
Жалпы «теріс» немесе «оң» зарядталған деген ұғымдар әрқашан ток көзінің полюсіне байланысты айтылады.
ГЭ-те де, электролизерде де теріс зарядталған электродта ē-ның артық мөлшері пайда болады, ал оң зарядталған электродта – ē жетіспейді. Катод және анод деген ұғымдар ē -ның электрод арқылы өту бағытына байланысты болады. Катод – бұл ГЭ-ке немесе электролизерге электрон тасымалданатын электрод және бұнда ē – артық мөлшерде болғандықтан реакцияласатын заттардың тотықсыздануы жүзеге асады. Анод – бұл ГЭ-тен немесе электролизерден электронды кері тасымалдайтын электрод, бұнда ē-ның жетіспеуіне байланысты реакцияласатын заттардың тотығуы жүзеге асады.
Сонымен, ГЭ – те:
(+) катодта: тотықсыздану: Cu 2+ + 2 ē → Cu o
Электролизерде:
(-) катодта: тотықсыздану: Na+ + ē → Na o
ГЭ – те:
(-) анодта: тотығу: Zn – 2 ē → Zn2+
Электролизерде:
(+) анодта: тотығу: 2Cl- – 2 ē → Cl2
Яғни, ГЭ-пен электролизердің принципиальды айырмашылығы оларда жүретін процестердің бағыттарының қарама-қарсылығында екенін байқауға болады.
| Zn2+ |
| Cu2+ |
| Zn |
| Cu |
| a) |
| Анод Тотығу (электрон беру) |
| Катод Тотықсыздану (электрон алу) |
Zn  Zn2+ + 2e Zn2+ + 2e
|
| -2e |
| Cu2++2е →Cu |
| K+ |
| A– |
| б) |
| Катод Тотықсыздану (электрон алу) |
| Анод Тотығу (электрон беру) |
| A– |
| +e– |
| A |
| –e– |
| K+ |
| +e– |
| K |
| K+ |
| – Катион |
| А– |
| – Анион |
14.35-сурет. а) гальваникалық элементтің және б) электролизердің жұмыс істеу принциптерін салыстырмалы түрде көрсететін сызбанұсқа.
Бірінші реттік өткізгіш, яғни металл арқылы электр тогы өткенде олар өзгеріссіз қалады. Ал, егер электр тогы электролит ерітінділері (яғни 2-реттік өткізгіштер) арқылы өтсе, электродтарда бір заттардың екінші біреулеріне айналатын процестер жүреді. Нәтижесінде электролит ыдырайды, бұндай процестер электролиз деп аталады.
Сонымен, электролиз дегеніміз – химиялық қосылыстың электр тогы әсерінен ыдырауы, нәтижесінде иондар разрядталады, яғни электролиз 2-параллельді жартылай процестер: анодты тотығу және катодты тотықсызданудан тұрады.
Электролиттердің сулы ерітінділерінің электролизіндегі жартылай процестерге тек электролит қана емес суда қатысады. Судың электролиттік ыдырауы кезінде катодта – сутегі (Н2), ал анодта – оттегі (О2) бөлінеді.
Сонда: катодта сутектің тотықсыздануы: 2Н+ + 2 ē ⇆ Н2. Ал, анодта оттектің тотығуы жүзеге асады: 4ОН- – 4 ē ⇆ О2 + 2Н2О
Біріктіріп жазсақ: 2Н+ + 4ОН- ⇆ Н2 + О2 + 2Н2О
Дәлірек жазсақ: 4Н3О+ + 4ОН- ⇆ 2Н2 + О2 + 6Н2О
Су мен электролиттің аттас иондары бір-бірімен бәсекелеседі және катодта қандай катион, ал анодта қандай анион разрядталатындығы олардың разрядталу кернеуінің мәніне байланысты болады, яғни кернеуі төмен иондар оңай разрядталады. Сызбанұсқада көрсетілгеніндей металдардың катиондарға ауысуы оңнан солға қарай артады.
Металдардың электрохимиялық кернеу қатары
Катиондарға ауысу тенденциясы
Li,K,Ba,Ca,Na,Mg,Al,Mn,Cr,Zn,Fe,Cd,Co,Ni,Sn,Pb [H] Cu,Ag,Pt, Au
бағалы емес металдар
бағалы (химиялық активті) металдар
Осы қатардың көмегімен әртүрлі электролиттердің электролизінің өнімдерін анықтауға болады. Анод материалының табиғатына байланысты, электролиз кезінде анодта әртүрлі процестер жүреді. Анодты дайындау үшін инертті металдар да қолданылады. Мысалы: көбіне Pt (платина), сирегірек Ir (иридий), одан да сирек Ta (тантал). Нағыз инертті электрод ретінде графитті электродтарды айтуға болады. Олар электрохимиялық технологияда кең қолданылады.
Көптеген технологиялық әдістер электрохимиялық процестерді еритін анодтың тікелей қатысуымен жүргізуге негізделген. Бұндай электролиздер: еритін анодты электролиз деп аталады. Еритін анод ретінде: Cu, Ni, Cd, Al және т.б. металдар қолданылады. Бұндай электролизде анод ериді, яғни тотығады және түзілген металл катиондары катодқа қарай қозғалып, катод бетінде тотықсызданып, бос металға айналады. Сөйтіп, еритін анодтың металы катод бетіне жабысады, яғни тұнады. Бұндай электролиздің техникалық мәні зор және металдарды тазалауда, яғни электрорафинирлеуде қолданылады. Сонымен қатар, бұндай электролиз кезінде ерітіндінің концентрациясын тұрақты етіп ұстау мүмкіндігі бар, яғни ерітінді кедейленуі болмайды және бұндай электролизде инертті анод қолданатын электролизбен салыстырғанда анодта газ түріндегі оттек бөлінбейді. Еритін анодтар гальванотехникада кең түрде қолданылады.
| Pt - сым |
| a) б) |
| Ag - сым |
14.36-сурет. Қосарланған тұзды көпіршелері бар хлорлыкүміс (а) және каломельді салыстырмалы электродтар (б): 1 – талданатын ерітіндімен байланысты қамтамасыз ететін асбест талшығы; 2 – KCl (қаныққан) сыртқы ерітіндісі; 3 – байланысқа арналған кішкентай саңылау; 4 – KCl (қаныққан) ішкі ерітіндісі, AgCl (қатты); 5 – KCl ерітіндісін енгізуге арналған саңылау; 6 – Нg2Cl2, Нg және KCl (қаныққан) қоспаларынан тұратын паста.
Потенциометриялық титрлеуде индикатор ролін индикаторлық электродтың потенциалы атқарады, сондықтан бұл әдісте 2-ші электрод қажет.
1) Индикаторлы электрод – бұл электродтың потенциалы анықтайтын компоненттің концентрациясына тәуелді.
2) Салыстырмалы электрод – бұл ерітіндідегі иондарға индифферентті, потенциалы тұрақты электрод.
Потенциометрияда қолданылатын индикаторлы электродтың материалы ерітіндідегі концентрациясын анықтайтын ионның табиғатына байланысты таңдау алынады. Мыс: аргентометрия әдісімен галогендерді титрлегенде индикаторлы электрод ретінде Ag пластинкасы қолданылады; қышқыл-негіздік титрлеуде – Н2-ті, хингидрон немесе шыны электродтары қолданылады.
Тотығу-тотықсыздану әдісінде қолданылатын индикаторлы электрод – реакцияға қатысатын компоненттерге инертті және жақсы электрөткізгіштігі болуы керек – ол Pt – электроды.
14.3.1 Электролиз. Электродтық потенциал, оған әсер ететін факторлар
Кез-келген металдың химиялық сипаттамасы ретінде оның қаншалықты оңай тотығуын айтуға болады. Оңай тотығатын металдарды бағалы емес, ал, қиын тотығатын металдарды бағалы металдар деп атайды. Металдарды олардың тотығу қабілеттерінің кемуіне қарай орналастырсақ, онда металдардың электрохимиялық кернеу қатарын алуға болады. Әрбір металл элоктрохимиялық кернеу қатарында өзінің оң жағында орналасқан металдарды олардың тұздарынан ығыстырып шығарады. Мысалы, мыс тұзының ерітіндісіне батырылған мырыш пластинкасына бос күйінде бөлінген мыс жабысады, ал Zn2+ – ерітіндіге ауысады.
Zn + CuSO4 → Zn SО4 + Cu
Қысқартылған түрде:
Zn + Cu2+ → Zn2+ + Cu
Бұл кезде тотығу – тотықсыздану реакциясы жүзеге асады.
Мырыш тотығады: Zn – 2ē → Zn 2 +
Мыс тотықсызданады: Cu 2+ + 2 ē → Cu
Бағалы емес металл мырыш Zn2+ ион күйінде ерітіндіге өтеді де, бағалы металл – мыс ерітіндіден бос металл күйінде бөлініп шығады. Нақты металдың тотықсыздандырғыш немесе тотықтырғыш болуы, оның электрохимиялық кернеу қатарындағы орналасуына байланысты. Келтірілген мысалдағы Cu –тың мырышпен (немесе Ғе-мен) салыстырғанда бағалылығы жоғары болса, күміспен салыстырғанда оның бағалылығы төмен, яғни соңғы жағдайда тотықсыздандырғыш болады:
Cu + 2Ag + → Cu2+ + Ag
Cu0 – 2 ē → Cu2+ тотығады (тотықсыздандырғыш).
2Ag+ +2 ē → 2Ag тотықсызданады (тотықтырғыш).
Ал Zn немесе Fe – мен салыстырсақ, Cu тотықтырғыш болады:
Cu2+ + Fe → Cu + Fe 2+
Қысқартылған түрде:
Cu2+ + 2 ē → Cu0 тотықсызданады (тотықтырғыш).
Электрохимиялық кернеу қатарына сутекте H+ (H3O+) орналастырылған. Бірақ сутектің металл емес екені белгілі. Сутекке дейін орналасқан барлық металдар сұйытылған қышқылдар ерітінділерінен сутекті ығыстырып шығарады. Мысалы:
Zn + 2H3O+ → Zn 2+ + H2  + 2H2O
+ 2H2O
Cu + H3O+ → (реакция жүрмейді). Бұл ереже металдардың тотығу- тотықсыздану реакцияларындағы жағдайын анықтайды: яғни электрохимиялық кернеу қатарында сутектің сол жағында орналасқан барлық металдар сутек катионына тотықсыздандырғыш сияқты әсер етеді.
Стандартты элетродтар. Заттардың тотығу немесе тотықсыздануға қабілеттілігінің өлшемі ретінде стандартты электродтық потенциалды айтуға болады. Егер металл пластинкасын оның тұзының сулы ерітіндісіне батырса (мысалы, Cu пластинкасын CuSO4 ерітіндісіне немесе Zn пластинкасын ZnSO4 ерітіндісіне) онда осындай жүйеде екі бір-біріне қарама-қарсы электрохимиялық процестің жүруі мүмкін:
1) катиондар тотықсызданып, атом күйінде металға жабысып, тұнады.
Mn+ + nē → Mo
2) металл атомдары тотығып, ерітіндіге өтуі мүмкін
Mo – nē → M n+
Катиондардың тотықсыздануға қабілеттігі оның тұз ерітіндісіндегі концентрациясына байланысты артады.
Ал металдың тотығуға қабілеттігі металдың химиялық табиғатына байланысты болады. Мысалы, мырыштың тотығуға қабілеттігі, мысқа қарағанда жоғарырақ. Егер ерітіндідегі заттардың концентрациясы бірдей деп есептесек, онда мырыш иондарының активтігі мыс иондарына қарағанда жоғарырақ болады. Электростатикалық тартылыс күшінің (катиондар (+) мен электрондар (ē) арасындағы) әсерінен катиондар металдың бетіне жақын орналасады.
Осының нәтижесінде қос электрлік қабат түзіледі де, электрлік потенциалдар айырымы, яғни гальвани-потенциал пайда болады.
Бұндай жүйені яғни, электролит ерітіндісіне батырылған металды электрод деп атайды. Басқаша айтсақ, электродтар – екі (1-реттік және 2-ші реттік) ток өткізгіш денелердің жүйесі болып табылады.
Бірінші реттік өткізгіштерге металдар, құймалар, металдық өткізгіштігі бар оксидтер, металл емес материалдар: мысалы графит жатады. Бұндағы заряд тасымалдаушылар – электрондар.
Екінші реттік өткізгіштерге электролиттер ерітінділері мен құймалар жатады, бұндағы заряд тасымалдағыштар – иондар. Екі электродтан тұратын құрылғыны: гальваникалық элемент деп атайды.
Металл/электролит шекарасында пайда болатын потенциал айырымын, яғни гальвани-потенциалды бір ғана электродтың көмегімен өлшеу мүмкін емес, өйткені ол 2-әртүрлі фазалар: қатты (металл) – сұйық (ерітінді) арасында пайда болады. Химиялық жағынан әртүрлі 2-электродтың гальвани потенциалдарының айырымын, олардың біреуін салыстырмалы электрод ретінде қарастырып қана, өлшеуге болады. Салыстырмалы электрод ретінде H+/H2(газ) – сутек электродын алуға болады. Оны немістің физик-химигі Нернст ұсынған. Бұл электрод Pt – пластинкасынан тұрады, ол Pt ұнтағымен қапталған, Pt – электроды HCl немесе H2SO4 ерітіндісіне батырылады. Осы ерітінді арқылы H2 газын үлкен қысыммен жібереді. Содан соң осы электродты қолданып гальваникалық элементтің электр қозғаушы күшін – Э.қ.к. (яғни, потенциалдар айырымын) компенсациялық әдіспен өлшейді. Әртүрлі электродтардың потенциалдар айырымын табу үшін стандартты жағдайды қолданады. Стандартты жағдайда: Т = 250C (298,15 К), қысым – 101,325 кПа (1атм), иондар концентрациясы – 1моль/л болады. Стандартты сутек электроды мен басқа бір электродтың стандартты жағдайда өлшенген потенциалдар айырымы сол электродтың стандартты потенциалы (Е0) деп аталады. Сутек электродының стандартты потенциалы шартты түрде 0-ге тең деп алынады. Көп жағдайда Н2 – электродын қолдану тиімсіз.
Сондықтан кейде каломель электродын Hg/Hg2Cl2 қолданады (14.36-сурет).
Электролизді практика жүзінде іске асыру үшін белгілі бір минимальды табалдырықтық кернеу қажет. Электродтарда разрядталатын катиондар мен аниондар неғұрлым қиын ыдырайтын болса, соғұрлым табалдырықтық кернеудің мәні жоғары болады. Бұндай кернеуді электролиттің ыдырау кернеуі деп атайды. Бұл – электродтар арасында пайда болатын минимальды кернеу, осы кернеуде электролиз басталады. Оның мәні, кем дегенде электродтық потенциалдар айырымына тең болады:
∆Е = Eан – Eкат
Еан – аниондардың разрядталу потенциалы;
Екат – катиондардың разрядталу потенциалы;
Олардың мәндері стандартты жағдайда (С = 1 моль/л, tо = 25оС, P =101,3 кПа) тотығу-тотықсыздану жұптарының стандартты потенциалдарының (Ео) шамасына тең болады. Стандартты жағдай:
Мысалы: СuCl2 – электролизінің ыдырау кернеуін анықтау керек.
Анодта: 2 Cl- – 2 ē → Cl2; Eo ан = + 1,358B
Катодта: Cu 2+ + 2 ē → Cu0; Eo кат = + 0,338В
Электролиздің жалпы сызбанұсқасы мынадай: CuCl2→Cu+Cl2

Сонымен, осы электролиздің жүруі үшін табалдырықтық кернеу 1,020В болуы керек.
Әдетте практика жүзінде разрядталу кернеуінің мәні, оның теориялық мәнінен жоғары болады. Өйткені, әр ұяшықтың өзінің ішкі кернеуі (iR) болады.
Есырт = Етаб. керн + iR;
Ео – мәні арқылы катодта немесе анодта ерітіндідегі бірнеше катион немесе анионның қайсылары разрядталатынын да анықтауға болады.
Мысалы: CuCl2 және FeCl2 ерітінділері электролиздеу қажет болса, қайсысында электролиз жүреді, соны алдын-ала анықтауға болады. CuCl2 – үшін ыдырау кернеуі ∆ Ео = + 1,020В болатыны жоғарыда айтылды. Енді FeCl2 электролизін қарастырайық:
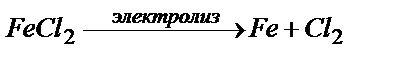
анодта: 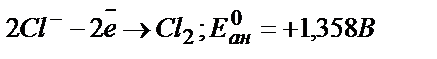
катодта: 
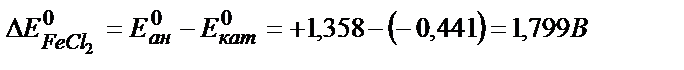
Бұдан, катодта Cu -тың ғана бөлінетінін көруге болады, ал Fe – бөлінбейді. Өйткені, CиCl2 – ыдырау кернеуі FeCl2 ыдырау кернеуіне қарағанда төмен.
Егер электродтық потенциалдың мәні Нернст теңдігімен есептелген тепе-теңдік потенциалынан ( ) өзгеше болса – ол поляризацияланған электрод деп аталады. Кез келген электродтық реакция бірнеше сатыдан тұрады:
) өзгеше болса – ол поляризацияланған электрод деп аталады. Кез келген электродтық реакция бірнеше сатыдан тұрады:
1) иондардың электродқа келуі;
2) электродта тотығу немесе тотықсыздану процестерінің, яғни электрохимиялық реакцияның жүруі;
3) электрод бетінде пайда болған заттардың ерітіндіге ауысуы. Осыған байланысты поляризацияның 2 түрі болады: 1) концентрациялық, 2) кинетикалық. Концентрациялық поляризация тотығатын не тотықсызданатын заттардың электродтың беткі қабаты мен ерітінді көлеміндегі концентрацияларының айырмашылығымен анықталады. Электрохимиялық реакция өте үлкен жылдамдықпен жүрсе, иондар электродтың беткі қабатына келіп үлгірмейді де, иондардың ерітіндінің көлеміндегі концентрациясы олардың электродтың беткі қабатындағы концентрациясынан көп болады. Концентрациялық поляризацияны азайту не жою үшін ерітіндіні жақсылап араластыру қажет.
Сонымен қатар, Нернст теңдігінен де катод пен анодтың потенциалдарының иондардың концентрациясына тәуелді екенін көруге болады. 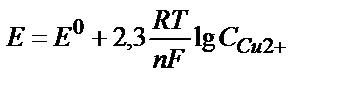 катодтың бетінде тотықсыздану процесі жүруі нәтижесінде мыс ионының концентрациясы азаяды, соның нәтижесінде мыс электродының потенциалы теріс жаққа ығысады. Мыс ионының концентрациясы 10-6 моль/л-ге дейін азайса,
катодтың бетінде тотықсыздану процесі жүруі нәтижесінде мыс ионының концентрациясы азаяды, соның нәтижесінде мыс электродының потенциалы теріс жаққа ығысады. Мыс ионының концентрациясы 10-6 моль/л-ге дейін азайса, 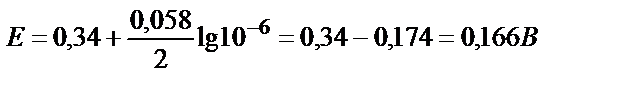
Кинетикалық поляризация электрохимиялық реакцияның жылдамдығы екі электродта да немесе бір электродта аз болуынан пайда болады. Бұндай жағдайда электродтарда процесс жүру үшін артық энергия қажет (артық кернеу).
Егер электрохимиялық ұяшыққа сырттан ток берілсе, онда электродтық потенциал өзінің тепе-теңдік мәнінен ауытқиды. Оның бірнеше себебі бар:
1) ток өтуі үшін алдымен иондардың анодқа не катодқа тартылу кернеуінен жоғары мән керек, яғни ол мәнді асып өту керек.
2) ток өткенде электрод бетіндегі концентрациялар СэOx/СэRed қатынасы, ерітіндідегі концентрацияға СерOx/СерRed қарағанда өзгереді, соның нәтижесінде электрод потенциалы өзінің тепе-теңдік мәнінен ауытқиды. Бұны, бұған дейін айтылғанындай, концентрациялық поляризация деп атайды.
3) егер 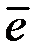 – тасымалдаушының жылдамдығы төмен болса, онда кинетикалық поляризация пайда болады
– тасымалдаушының жылдамдығы төмен болса, онда кинетикалық поляризация пайда болады 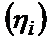 және оны жою үшін артық энергия қажет болады.
және оны жою үшін артық энергия қажет болады.
2) ұяшықтағы Фарадеев тогы бірінен соң бірі жүзеге асатын 3 стадияның нәтижесінде пайда болады: а) масса алмасу (диффузия), яғни Ох немесе Red түрлерінің электродқа тасымалдануы; б) электрохимиялық стадия, яғни электрод бетінде Ох – тотықсыздануы немесе Red – тотығуы; в) электрохимиялық стадия өнімдерінің электрод бетінен ерітіндіге дейін тасымалдануы.
Әрбір стадияның өзінің жылдамдығы болады. Мысалы, rox - бұл Ox электродқа тасымалдану жылдамдығы болса, rRed - тотықсыздану өнімінің электродқа тасымалдану жылдамдығы; ал 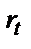 – электрохимиялық стадия жылдамдығы. Масса тасымалдану жылдамдығы Ох пен Red табиғатына және олардың концентрациясы мен температураға да байланысты болады. Электрохимиялық стадия жылдамдығы электрохимиялық жүйе Ох/Red табиғатына байланысты өзгереді және концентрация мен электродтық потенциалға байланысты болады. Жалпы электродтық процестің жылдамдығы ең баяу жүретін стадия жылдамдығымен анықталады. Қайтымды электрохимиялық жүйе (электродтық процесс) деп
– электрохимиялық стадия жылдамдығы. Масса тасымалдану жылдамдығы Ох пен Red табиғатына және олардың концентрациясы мен температураға да байланысты болады. Электрохимиялық стадия жылдамдығы электрохимиялық жүйе Ох/Red табиғатына байланысты өзгереді және концентрация мен электродтық потенциалға байланысты болады. Жалпы электродтық процестің жылдамдығы ең баяу жүретін стадия жылдамдығымен анықталады. Қайтымды электрохимиялық жүйе (электродтық процесс) деп  тасымалдау жылдамдығы масса жылдамдығынан әжептәуір көп болатын жүйені айтады:
тасымалдау жылдамдығы масса жылдамдығынан әжептәуір көп болатын жүйені айтады:
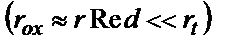 . Егер
. Егер  тасымалдау стадиясы электродтық процесс жылдамдығынан төмен (яғни
тасымалдау стадиясы электродтық процесс жылдамдығынан төмен (яғни 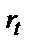 – аз) болса, онда бұндай электродтық процесті қайтымсыз процесс деп атайды. Егер үш стадияның да жылдамдығы бір-біріне тең болса
– аз) болса, онда бұндай электродтық процесті қайтымсыз процесс деп атайды. Егер үш стадияның да жылдамдығы бір-біріне тең болса 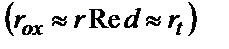 , бұндай электродтық процесс – квазиқайтымды деп аталады.
, бұндай электродтық процесс – квазиқайтымды деп аталады.
Әртүрлі электродтарда H2 мен О2 – нің бөлініп шығуын сипаттауға Тафель теңдігі қолданылады: η = а+в lgi.
Бұл газдар (H2; O2) көптеген электродтарда артықша кернеумен бөлінеді.
Сутегінің өзінің ерекшелігі бар. 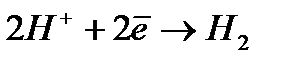 реакциясы электродтың табиғатына байланысты әртүрлі жылдамдықпен жүреді. Pt және Pt -тобы металдарынан, сонымен қатар Fe -тобы металдарынан жасалған электродтарда H2 -нің тотықсыздануы аз артықша кернеумен жүреді. Ал Hg, Pb, Tl, Cd, Zn сияқты металдарда ток тығыздығы өте аз болғанның өзінде (>10–5 А/см2), сутегінің бөлініп шығуы үшін берілетін артықша кернеудің мәні бір және одан да артық вольт шамасында болады. Осы құбылысты түсіну үшін H2 -нің тотықсыздануы қандай сатылардан тұратынын қарастырсақ:
реакциясы электродтың табиғатына байланысты әртүрлі жылдамдықпен жүреді. Pt және Pt -тобы металдарынан, сонымен қатар Fe -тобы металдарынан жасалған электродтарда H2 -нің тотықсыздануы аз артықша кернеумен жүреді. Ал Hg, Pb, Tl, Cd, Zn сияқты металдарда ток тығыздығы өте аз болғанның өзінде (>10–5 А/см2), сутегінің бөлініп шығуы үшін берілетін артықша кернеудің мәні бір және одан да артық вольт шамасында болады. Осы құбылысты түсіну үшін H2 -нің тотықсыздануы қандай сатылардан тұратынын қарастырсақ:

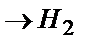
Артықша кернеу электрохимиялық реакцияның бір сатысының баяу жүруіне байланысты болады.
Баяу жүретін реакциялар: 1) сутегі иондарының электронды қосып алуы – баяу разрядталу теориясы; 2) сутегі атомдарынан сутегі молекуласының түзілуі – рекомбинация теориясы.
Hg, Cd, Tl, Pb және т.б. металдарда сутегінің разрядталу сатысы баяу жүреді.
Ал Pt -топшасындағы металдарда рекомбинация сатысы баяу жүреді.
Мұндай айырмашылықтың болуы – металдардың сутегін қаншалықты адсорбциялайтындығына, яғни адсорбциялау қабілеттіліктеріне байланысты болады. Pt – тобының металдары H2 -гін көп мөлшерде адсорбциялайды және H2 молекулаларын диссоциацияға ұшыратады, соның нәтижесінде металдың беткі қабатында мынадай Н2 2Н тепе-теңдік орнайды. Pt- тобының металдарынан жасалған электродтарды ерітіндіге батырғанда Н++ 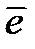 Н тепе-теңдігі жеңіл орнайды. Соған сәйкес алмасу тогының мәні үлкен болады. Алмасу тогы үлкен болғандықтан катодты не анодты токтың белгілі мәнін алу үшін электрод аз мәнге поляризацияланады.
Н тепе-теңдігі жеңіл орнайды. Соған сәйкес алмасу тогының мәні үлкен болады. Алмасу тогы үлкен болғандықтан катодты не анодты токтың белгілі мәнін алу үшін электрод аз мәнге поляризацияланады.
Алмасу тогы қаншалықты көп болса соншалықты разрядталу-ионизациялану сатысына берілетін артықша кернеудің мәні аз. Pt- тобының металдары Н2 2Н тепе-теңдігін оң жаққа ығыстырғандықтан, сутегі молекуласын алу жағына қарай тепе-теңдікті ығыстыру үшін қосымша энергия керек, яғни артықша кернеу беру керек. Бұл артықша кернеудің мәні онша көп емес. Hg, Pb және оларға ұқсас металдарда сутегі өте нашар адсорцияланады, ол H2 молекуласының атомдық түріне ауысу қабілеттігі одан да аз. Мұндай электродтарда сутегі атомының мөлшері өте аз болғандықтан Н++ 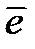 Н; Н Н++
Н; Н Н++ 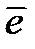 алмасу мүмкіндігі және соған сәйкес алмасу тогының мәні өте аз. Алмасу тогы аз болған жағдайда сутегі иондарының тотықсыздануы белгілі бір жылдамдықпен жүруі үшін электродқа артықша кернеудің үлкен мәнін беру қажет. Бұл жағдайда сутегінің артықша кернеумен бөлінуі сутегінің разрядталу сатысымен байланысты.
алмасу мүмкіндігі және соған сәйкес алмасу тогының мәні өте аз. Алмасу тогы аз болған жағдайда сутегі иондарының тотықсыздануы белгілі бір жылдамдықпен жүруі үшін электродқа артықша кернеудің үлкен мәнін беру қажет. Бұл жағдайда сутегінің артықша кернеумен бөлінуі сутегінің разрядталу сатысымен байланысты.
Кей металдарда (мысалы, мыста) сутегінің артықша кернеумен бөлінуі екі сатымен де анықталады: баяу разрядталу және атомдардың молекулаға айналуы.
14.2-кесте
Әртүрлі электродтардағы сутегінің артықша кернеулері
| Металл | Сутегінің алмасу тогы, А/см2 | Сутегін бөліп, шығаруға сәйкес артықша кернеу, В |
| Tl, Pt | 10–13 | 1,5 |
| Hg, Cd | 10–12 | 1,4 |
| Zn | 10–10 | 1,2 |
| Cu | 10–8 | 0,8 |
| Fe, Ni | 10–6 | 0,6 |
| Pt | 10–3 | 0,1 – 0,3 |
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 1806; Нарушение авторских прав?; Мы поможем в написании вашей работы!