
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Мыс электролизі 1 страница
|
|
|
|
Мыс ионы катодта сатылап тотықсызданады:
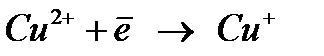
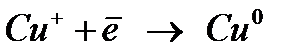
Мыстың сатылап тотықсыздануы мынадай қиындыққа әкеледі:
1) Катодта пайда болған бір зарядталған мыс иондары электродтың беткі қабатынан ерітіндіге өткенде, ерітіндіде еріп жүрген оттегімен әрекеттесуі мүмкін: 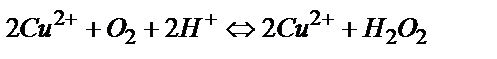 одан әрі
одан әрі 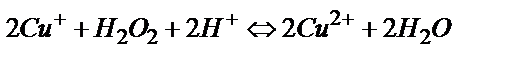 . Сондықтан системадан өтетін токтың қайсы бір мөлшері қосымша реакцияға жұмсалады. Бұл қосымша процесті жою үшін электролизді ыстық ерітіндіде жүргізеді (газдардың ерігіштігі tо – артқан сайын кемитіндігі белгілі) және электродта пайда болған бір зарядты мыс ерітіндіге ауысып үлгірмей одан әрі металл түріне дейін тотықсыздану үшін мүмкін болғанша токтың тығыздығын көбейтеді.
. Сондықтан системадан өтетін токтың қайсы бір мөлшері қосымша реакцияға жұмсалады. Бұл қосымша процесті жою үшін электролизді ыстық ерітіндіде жүргізеді (газдардың ерігіштігі tо – артқан сайын кемитіндігі белгілі) және электродта пайда болған бір зарядты мыс ерітіндіге ауысып үлгірмей одан әрі металл түріне дейін тотықсыздану үшін мүмкін болғанша токтың тығыздығын көбейтеді.
2) Егер мыстың тотықсыздануымен қатар көп мөлшерде H2 бөлінсе, электродтың бетінде оксидке айналатын бір зарядталған мыс гидроксидінің түзілу қаупі бар. Бір зарядталған мыстың гидроксиді екі заряталған мыстың гидроксидіне қарағанда қышқыл ортада бөлініп шығады. Бұны олардың ЕК мәндерінен де байқауға болады: ЕКCuОH =10–15; 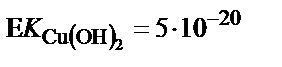 Электрод бетіндегі
Электрод бетіндегі 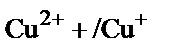 қатынасы 1000/1 сәйкес болады. Бұл қатынасты табу үшін
қатынасы 1000/1 сәйкес болады. Бұл қатынасты табу үшін 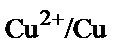 және
және 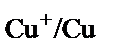 жүйелерінің тотығу-тотықсыздану потенциалдарын қарастыру керек.
жүйелерінің тотығу-тотықсыздану потенциалдарын қарастыру керек.
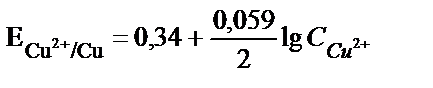
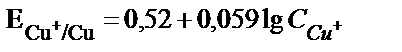
Электродта тепе-теңдік орнағанда
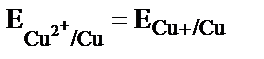 мәндерін орындарына қойсақ,
мәндерін орындарына қойсақ,
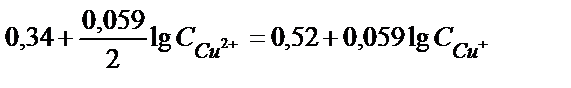
(содан соң ортақ бөлімге келтіреміз) 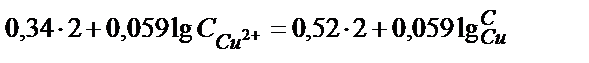
енді lg – дерді теңдіктің бір жағына шығарсақ.
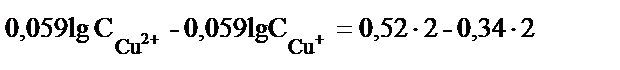
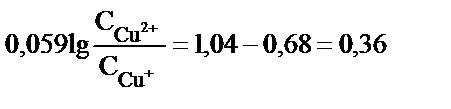
 . Егер
. Егер 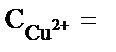 1моль/л;
1моль/л; 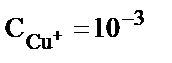 моль/л болса, онда
моль/л болса, онда 
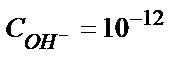 ; pH =2;
; pH =2;
Яғни, бір зарядталған мыстың гидроксиді ерітіндінің pH=2 болғанда тұнбаға түсе бастайды.
Ал, 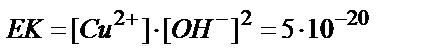
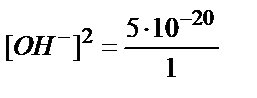 ;
; 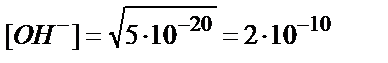 ; pOH =10,3; pH =3,7.
; pOH =10,3; pH =3,7.
Яғни 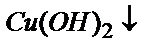 тұнбаға
тұнбаға 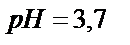 болғанда түседі. Электролизге мыстың күкірт қышқылды ерітіндісін пайдаланады. Сутегінің бөлінуін азайту үшін бұл ерітіндіге HNO3 қосады. Нитрат-иондары мыс электродында сутегінен бұрын аммоний иондарына дейін тотықсызданады, сондықтан сутегінің бөлініп шығу жылдамдығы азаяды. Екінші жағынан электродтың бетінде пайда болған NH3 мыс иондарымен комплекс түзіп, гидроксид тұнбаларының пайда болуына кедергі жасайды. Есте ұстайтын бір нәрсе, H2SO4 пен HNO3 қоспасын алғанда, бөлініп шыққан мыстың тұнбасын токты ажыратпай тұрып жуу керек, әйтпесе пайда болған мыс (Cuо) қышқылдардың қоспасында қайтадан еріп кетуі мүмкін.
болғанда түседі. Электролизге мыстың күкірт қышқылды ерітіндісін пайдаланады. Сутегінің бөлінуін азайту үшін бұл ерітіндіге HNO3 қосады. Нитрат-иондары мыс электродында сутегінен бұрын аммоний иондарына дейін тотықсызданады, сондықтан сутегінің бөлініп шығу жылдамдығы азаяды. Екінші жағынан электродтың бетінде пайда болған NH3 мыс иондарымен комплекс түзіп, гидроксид тұнбаларының пайда болуына кедергі жасайды. Есте ұстайтын бір нәрсе, H2SO4 пен HNO3 қоспасын алғанда, бөлініп шыққан мыстың тұнбасын токты ажыратпай тұрып жуу керек, әйтпесе пайда болған мыс (Cuо) қышқылдардың қоспасында қайтадан еріп кетуі мүмкін.
Мыстың қаншалықты толық бөлінгендігін білу үшін, электролизерге тұнба деңгейінен асырып су құяды. Егер мыс толық бөлінген болса, онда катодтың сумен жанасқан жерінде тұнба пайда болмайды. Не болмаса, K3[Fe(CN)6] – мен тамшылы реакция жасапта тексеріп көруге болады.
Никельдің электролизі
Ni2+/Ni жүйесінің стандартты потенциалы –0,25 В-қа тең. Никельде сутегі бөлінуіне сәйкес артықша кернеу онша көп емес, ал никельдің өзінің бөлінуіне көп артықша кернеу қажет. Сондықтан катодта сутегі мен никель қатарласа тотықсызданады. Электрогравиметриялық әдіспен никельді анықтау үшін электролизді аммиакты ерітіндіден жүргізеді. 0,1 – 0,15 г никелі бар ерітіндіге 5 г -дай кристалды аммоний сульфатын салады, оған 20 мл 25% аммиак ерітіндісін құяды да, ерітіндіні 100 мл-ге дейін сұйылтады. Аммиакты ортада (pH=9) никельдің потенциалы – 0,25 В тан – 0,49 В-қа дейін теріс мәнге қарай ығысады. 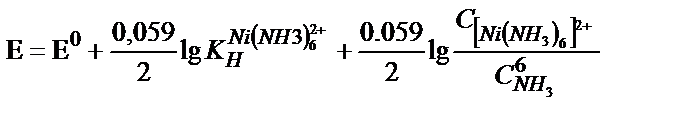 , сутегінің потенциалы да теріс жаққа ығысады
, сутегінің потенциалы да теріс жаққа ығысады 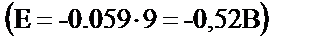 . Сондықтан, нейтралды не қышқылдық ортаға қарағанда, аммиакты ортада сутегінің бөлінуі аз дәрежеде жүреді. Сонымен қатар аммиакты комплекске байланысқан никель иондары, сутегінің бөлінуі нәтижесінде электродтың беткі қабатында гидроксид иондары көбейсе де, гидроксид тұнбасын бермейді. Электролизді бөлме температурасында жүргізуге болады, реакцияның аяқталғанын диметилглиоксиммен тамшылы реакция жүргізіп анықтайды.
. Сондықтан, нейтралды не қышқылдық ортаға қарағанда, аммиакты ортада сутегінің бөлінуі аз дәрежеде жүреді. Сонымен қатар аммиакты комплекске байланысқан никель иондары, сутегінің бөлінуі нәтижесінде электродтың беткі қабатында гидроксид иондары көбейсе де, гидроксид тұнбасын бермейді. Электролизді бөлме температурасында жүргізуге болады, реакцияның аяқталғанын диметилглиоксиммен тамшылы реакция жүргізіп анықтайды.
Аналитикалық химияда электролиз гравиметриялық анализден басқа, яғни металдарды бір бірінен бөлуде де қолданылады. Көпкомпонентті ерітіндіден металдарды бөлу мүмкіншілігін олардың стандартты потенциалдарын салыстырып анықтауға болады. Мысалы, ерітіндіде Ag және Cu тұздары бар дейік: 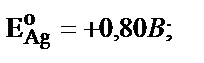 .
. 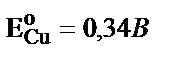 . Күміс электродта толық бөлініп шыққанда, яғни оның концентрациясы 10–6М дейін азайғанда
. Күміс электродта толық бөлініп шыққанда, яғни оның концентрациясы 10–6М дейін азайғанда 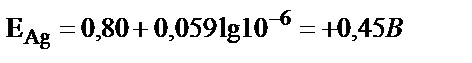 . Бұл потенциалда мыс әлі бөлінбейді, өйткені оның бөліну потенциалы +0,34В. Сондықтан күмісті мыстан толық бөліп алуға болады.
. Бұл потенциалда мыс әлі бөлінбейді, өйткені оның бөліну потенциалы +0,34В. Сондықтан күмісті мыстан толық бөліп алуға болады.
| I |
| Е1 E3 E2 |
| Е, B |
| 14.37-сурет. Электродтағы металдың бөліну потенциалын анықтау. |
Металдарды толық бөлу үшін электролизді катодты потенциалды қадағалай отырып жүргізген дұрыс. Электролизді Е3 потенциалында жүргізсе М1 металы толық электродта бөлінеді де, М2 металы ерітіндіде қалады.
Металдарды бөлуде электролизді жиі Hg – электродын қолданып жүргізеді. Сынаптың артықшылығы: ол сұйық Me. Сондықтан,
1) электролиз нәтижесінде бөлінген Me электрод бетінде емес амальгама түзіп сынаптың ішінде болады;
2) электролиз жүргенде сынаптың беті өзгермей қалады;
3) Hg – электродында H2 – үлкен артықша кернеумен бөлінеді. Сондықтан Hg – электродында қышқыл ерітіндіде Zn, Cd, Fe -ді, ал нейтралды не сілтілік ерітінділерде сілтілік, сілтілік жер металдарын бөліп шығаруға болады.
14.3-кесте
Me -дың E0 – және Hg -та бөліну потенциалдары
| Me | E0, B | EHg, B | Me | E0, B | EHg, B |
| Zi | - 3,05 | -2,20 | Te | -0,33 | -0,23 |
| K | -2,93 | -1,88 | Pb | -0,13 | -0,13 |
| Na | -2,71 | -1,82 | Sn | -0,16 | -0,16 |
| Mn | -1,18 | -1,14 | Cu | +0,34 | +0,27 |
| Zn | -0,76 | -0,77 | Bi | +0,32 | +0,28 |
| Cd | -0,40 | -0,33 | Fe | -0,44 | -1,02 |
| Jn | -0,34 | -0,36 | Co | -0,25 | -1,18 |
| Ni | -0,22 | -0,85 |
Сонымен, электролизді жүргізу барысында ток пен потенциалды қадағалап отыру керек екен.
Бірақ тек осы ток пен потенциалды ғана қадағалап қоймай белгілі бір тәжірибелік жағдай жасау керектігін де ескерген жөн. Электролиз жолымен бөлінген тұнба электродқа жақсы жабысқан, тығыз және тегіс (жылтыр) болуы қажет, жуғанда, кептіргенде, өлшегенде тұнба ауамен әрекеттеспеуі және механикалық жолмен жойылмауы керек.
Тұнба алуға әсер ететін факторларға қатарласа жүретін электрохимиялық процесс, токтың тығыздығы, tо, араластыру, ерітіндінің pH, ерітіндіде комплекс түзетін заттардың болуы және т.б. жатады. Катодта сутегінің бөлінбегені дұрыс, өйткені тұнба тегіс болмайды, сондықтан бұндай жағдайда катодты потенциалды қадағалайды және деполяризатор (HNO3) қосады.
14.3.2 Потенциометрия және потенциометриялық титрлеу
Потенциометрлік анықтаулар электродтың тепе-теңдік потенциалының анықталатын ионның активті концентрациясына тәуелділігіне негізделген. Анықтаулар үшін индикаторлы электродпен салыстырмалы электродтан тұратын гальваникалық элемент құрастыру қажет. Сонымен қатар индикаторлы электродтың потенциалын өлшеу мүмкіндігі болған дұрыс. Потенциометрияның да тура және жанама түрлерін (потенциометриялық титрлеуді) ажыратады. Потенциометрияда мембранды (ионселективті) және металдық индикаторлы электродтарды қолданады. ИЮПАК анықтамалары бойынша ионселективті электродтар – сенсорлар (сезімтал элементтер, қабылдағыш құрылғылар), олардың потенциалдары ерітіндідегі анықталатын ионның активті концентрациясының логарифміне (lg a) сызықты түрде тәуелді болады. Бұндай электродтардың негізгі құрамдас бөлігі – жартылай өткізгіш мембрана – ол электродтың ішкі бөлігін (ішкі ерітіндіні) анықталатын ерітіндіден бөліп тұрады және белгілі бір иондарды (катион немесе аниондарды) ғана өткізеді.
Мембраналардың бұндай қасиеті ионогенді топтардың болуына байланысты. Егер мембрана А+ – ионының екі активтіліктері а1 (анықталатын ерітінді) және а2 (ішкі ерітінді) ерітінділерімен беттесетін болса, онда мембрананың ішкі және сыртқы жақтарында да ион алмасулары болады. А+ – ионының ерітіндідегі және мембранадағы активтіктерінің әртүрлі болуына байланысты мембрананың екі жағында шекті потенциалдар Е1 және Е2 пайда болады. Ішкі және сыртқы ерітінділерге батырылған салыстырмалы электродтардың көмегімен Е1 мен Е2-нің айырымын өлшеуге болады. Бұны мембраналық потенциал деп атайды: Ем= Е1 – Е2 =0,059 lg а 1/ а 2. Ішкі ерітіндідегі А+ – ионының активтігі тұрақты болады, сондықтан Ем= const + 0,059 lg а 1. Мембранды электродтың потенциалы анықталатын ерітіндідегі А+ – ионының активтілігінің логарифміне сызықты түрде тәуелді болады. ИЮПАК нұсқауларына байланысты бірінші реттік ионселективті электродтар – кристалды мембраналары бар электродтар, қатты матрицалы (шыны) электродтар; қозғалғыш негізі бар электродтар – оң зарядталған, теріс зарядталған, зарядталмаған («нейтральды тасымалдаушылары бар»); сенсибилизирленген (активтендірілген) электродтар – газға сезімтал және ферментті деп бөлінеді.
Кристалдық мембраналы электродтар. Кристалдық гомогенді мембраналарды жеке кристалды қосылыстардан (LaF3, Ag2S) немесе кристалды заттардың гомогенді қоспасынан (Ag2S+AgCl; Ag2S+CuS) дайындайды. Гетерогенді кристалдық мембраналар дайындағанда электродты-активті затты инертті матрицамен (силиконды шайырмен) араластырады немесе оны гиброфобталған графитке жағады. Бұндай мембраналардың электр өткізгіштігі тордағы радиусы және заряды неғұрлым кіші болатын ионның тордың вакансияларына ауысу қабілетімен анықталады.
Кристалды мембраналы электродтың ең жетілген түріне F- – селективті электрод жатады (14.38-сурет). Оның мемабранасы лантан фторидінің монокристалының пластинкасынан жасалған.
14.38-сурет. Фторид-селективті электрод: 1 – LaF пластинасы; 2 – стандартты NaF+NaCl ішкі ерітіндісі; 3 – ішкі салыстыру электроды; 4 – оқшаулағыш; 5– токөткізгіш. | 14.39-сурет. рН өлшеуге арналған шыны электрод: 1 – рН-қа сезімтал әйнек мембрана; 2 – 0,1 М НCl ерітіндісі, қаныққан AgCl; 3 – күміс сым; 4 – әйнек түтікше; 5 – оқшаулағыш; 6 – токөткізгіш. |
Дұрыс нәтиже алу мақсатында электродтарды үнемі градуирлеп тұрады, ол үшін стандартты буферлі ерітінділерді қолданады (14.4-кесте).
14.4-кесте
Шыны электродты градуирлеуде қолдану үшін ұсынылатын буферлі қоспалар
| Буферлі қоспаның құрамы | pH (25 oC) |
| Калий гидротартраты (қанық) | 3,557 |
| KHC4H4O6 (0,05M) | 3,776 |
| Калий гидрофталаты (қанық) (0,05M) | 4,004 |
| KH2PO4+NaHPO4 (0,025M) | 6,863 |
| KH2PO4 (0,008695M) + NaH2PO4 (0,0343M) | 7,415 |
| Na2B4O7 (0,01M) | 9,183 |
| NaHCO3 + Na2CO3 (0,025M) | 10,014 |
Қозғалмалы негізі бар мембраналы электродтар сұйық мембраналардан тұрады (14.40-сурет).
| 14.40-сурет. Сұйық мембраналы ионселективті электрод (қозғалмалы тасымалдаушысы бар): 1 – мембрана; 2 – ионит; 3 – стандартты ішкі ерітінді; 4 – ішкі салыстырмалы электрод |
Сұйық мембраналар – бұлар ионалмасқыштың ерітіндісі немесе органикалық еріткіштегі «бейтарап тасымалдағыш». Органикалық еріткіш саңылаулы полимерге құйылады. Кейбір ионселективті электродтардың сипаттамалары 14.5-кестеде берілген.
14.5-кесте
Кейбір ионселективті электродтардың сипаттамалары
| Анықталатын ион | Мембрана | Электродты функцияны орындау интервалы | Ескертулер |
| Қатты кристалды мембраналы электродтар | |||
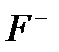
| LaF3 | 10–6 – 1 M | pH 4 – 8, 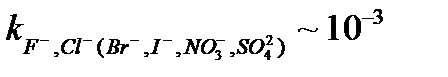
|
| Ag+ | Ag2S | 10–7 – 1 M | pH 2 – 9, 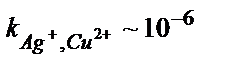 , , 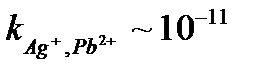
|
| Cu2+ | CuS/Ag2S | 10–8 – 1 M | pH 0 – 14, Ag+ және Hg2+ иондары кедергі келтіреді |
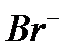
| AgBr/Ag2S | 5·10–7 – 1 M | pH 2 – 12, 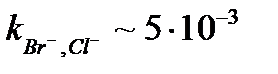 , , 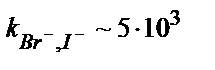 , ,
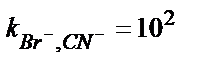 , , 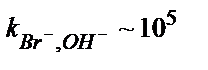
|
| Қозғалмалы негізі бар электродтар | |||
| Ca2+ | Са дидодецилфосфат | 5·10–5 – 1 M | pH 5,5 – 11, 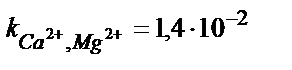 , , 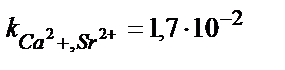
|
| K+ | Валиномицин | 5·10–5 – 1 M | pH 2 – 11, 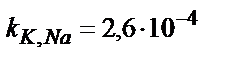 , , 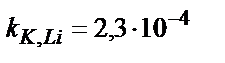
|
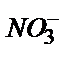
| Ni-дің 1,10-фенантролинаты | 5·10–5 – 1 M | pH 2 – 12, 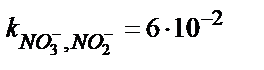 , ,  , ,
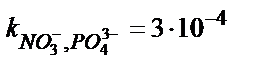 , , 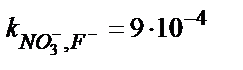
|
| Қатты матрицалы электродтар (шыны) | |||
| H+ | Шыны құрамы SiO2 – CaO – BaO – Cs2O – Li2O – La2O3 | pH 0,5 – 14 | 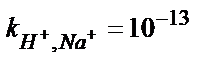
|
| Na+ | Шыны құрамы Li2O – B2O3 – SiO2 | 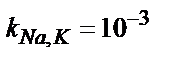
|
Сенсибилизирленген (активтендірілген) электродтар. Газға сезімтал электродтар – бұлар қабылдағыш құрылғылар, олар индикаторлы электрод пен салыстырмалы электродты біріктіреді және олардың газ өткізетін мембраналары немесе анықталатын ерітіндіні электролиттің аралық ерітіндісінің жұқа қабықшасынан бөліп тұратын ауа қуысы болады (14.41-сурет).
| 14.41-сурет. NH3-ты анықтауға арналған газселективті электрод: 1 – гидрофобты газ өткізетін мембрана; 2 – электролиттің ішкі ерітіндісі; 3 – анализденетін ерітінді; 4 – NH4+-ке селективті электрод; 5 – салыстырмалы электрод. |
Бұндай электрод арқылы анализденетін газдағы компоненттің парциалды қысымы өлшенеді. Газға сезімтал электродтардың практикада қолданылуы 14.6-кестеде келтірілген.
14.6-кесте
Газға сезімтал электродтардың қолданылуы
| Анықтала-тын газ | Индикаторлы электрод | Анықтала тын ерітіндінің pH | Ішкі ерітіндінің құрамы | Анықтау шегі, М |
| СО2 | pH – сезімтал шыны электрод | < 4 | 10–2 M NaHCO3+ +10–2 M NaCl | 10–5 |
| NH3 | pH – сезімтал шыны электрод | > 12 | 10–2 M NH4Cl+ +10–1 M КNО3 | 10–6 |
| SO2 | » | < 0,7 | 10–3 M NaHSO3 pH 5 | 5·10–6 |
| HF | F – селективті | < 2 | 1 M H+ | 10–8 |
| H2S | S2– – селективті | < 5 | Цитратты буферлі ерітінді, pH 5 | 10–7 |
Ферментті электродтар – бұлар қабылдағыш құрылғылар, олардағы ионселективті электрод құрамында фермент бар жұқа қабықшамен (немесе гельмен) қапталған (14.42-сурет).
|
| 14.42-сурет. 1 – құрамында уреаза ферменті бар гель; 2 – NH4+ – иондарына селективті шыны мембрана; 3 – NH4+- ішкі стандартты ерітіндісі; 4 – субстрат; 5 – ішкі салыстырмалы электрод. |
Фермент органикалық немесе бейорганикалық заттармен (субстратпен) әрекеттесіп зат (ион, молекула) түзеді. Осы түзілген заттардың құрамына байланысты электродтың көрсеткіші өзгереді. Электродтың жұмыс істеу негізінде жатқан ферментативті реакцияның нәтижесінде түзілетін бөлшек электродтың жауабын қамтамасыз етеді:
Анықталатын зат (субстрат)  ион (молекула)
ион (молекула)
Әрбір фермент тек белгілі бір реакцияға ғана катализатор бола алады. Мысалы, несепнәрді мынадай ферментативті реакция арқылы анықтайды:
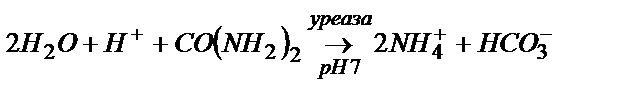
Ферментті электродтардың қолданылуы жөніндегі мәліметтер 14.6-кестеде берілген.
14.6-кесте
Ферментті электродтардың қолданылуы
| Субстрат | Фермент | Электрохимия-лық активті бөлшек | Индикаторлы электрод |
| Пенициллин | Пенициллиназа | H+ | pH -қа сезімтал шыны электрод |
| Несепнәр | Уреаза | 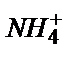
| 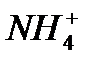 -ға сезімтал шыны электрод -ға сезімтал шыны электрод
|
| NH3 | NH3 – ты газды | ||
| Құмырсқа қышқылы | Алкогольоксидаза | СО2 | СО2 – ды газды |
| Глюкоза | Глюкозооксидаза | H+ | pH -қа сезімтал шыны электрод |
| Фосфат-ионы | Сілтілі фосфотаза | О2 | платина электроды |
Металдық электродтар
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 2392; Нарушение авторских прав?; Мы поможем в написании вашей работы!