
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства оснований
|
|
|
|
Получение труднорастворимых оснований
Получение оснований
Получение растворимых оснований
а) Взаимодействие щелочных и щелочноземельных металлов с водой, например: 2Na + 2H2O → 2NaOH + H2↑,
Ca + 2H2O → Ca(OH)2 + H2↑.
б) Взаимодействие оксидов щелочных и щелочноземельных металлов с водой, например: Na2O + H2O → 2NaOH,
CaO + H2O → Ca(OH)2.
в) Взаимодействие бинарных соединений щелочных и щелочноземельных металлов с водой с образованием газообразных веществ,
например: NaH + H2O → NaOH + H2↑,
гидрид натрия
Ca3N2 + 6H2O → 3Ca(OH)2 + 2NH3↑.
нитрид кальция
г) Электролиз водных растворов солей щелочных, щелочноземельных металлов и бескислородных кислот, например:
NaCl + 2H2O 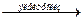 2NaOH + Cl2 + H2.
2NaOH + Cl2 + H2.
а) Взаимодействие щелочей и растворимых солей металлов, например:
2NaOH + FeSO4 → Fe(OH)2↓ + Na2SO4,
2KOH + MnCl2 → Mn(OH)2↓ + 2KCl.
б) Взаимодействие растворимых бинарных соединений металлов с водой, например: MgS + 2H2O → Mg(OH)2 + H2S↑.
1) Водные растворы щелочей изменяют окраску индикаторов (таблица 4).
Таблица 4 – Окраска индикаторов в растворах щелочей
| Индикатор | Цвет индикатора | Цвет индикатора в растворе щелочи (рН > 7) |
| лакмус | фиолетовый | синий |
| фенолфталеин | бесцветный | малиновый |
| метилоранж | оранжевый | желтый |
2) При растворении в воде основания диссоциируют.
Сильные однокислотные основания диссоциируют в водных растворах полностью (на 100%) на катионы металла и анионы – гидроксогруппы 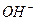 , например:
, например: 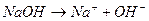 ,
, 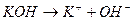 .
.
Слабые основания в водных растворах диссоциируют незначительно. Процесс диссоциации слабых электролитов обратим. При этом устанавливается химическое равновесие между молекулами слабого основания и ионами, на которые идет диссоциация, например: 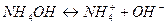 .
.
Многокислотные основания в водных растворах диссоциируют по ступеням с постепенным отщеплением аниона – гидроксогруппы 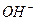 .
.
Таким образом, сколько анионов – гидроксогруппы 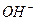 содержится в молекуле основания, столько будет ступеней диссоциации у этого основания.
содержится в молекуле основания, столько будет ступеней диссоциации у этого основания.
Нужно помнить, что многокислотные сильные основания по первой ступени диссоциируют необратимо, а слабые основания по всем ступеням диссоциируют обратимо, например:
1 ступень 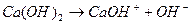 , ,
| 1 ступень 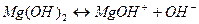 , ,
|
2 ступень 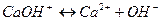 . .
| 2 ступень 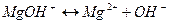 . .
|
Ступенчатой диссоциацией многокислотных оснований объясняется образование основных солей.
3) Все основания (растворимые и труднорастворимые) взаимодействуют с кислотами (как сильными, так и слабыми) с образованием соли и воды.
Реакция между кислотой и основанием называется реакцией нейтрализации, например:
KOH + HCl → KCl + H2O,
Fe(OH)2 + 2HNO3 → Fe(NO3)2 + 2H2O,
2NaOH + H2S → Na2S + 2H2O.
4) Щелочи взаимодействуют с кислотными и амфотерными оксидами, например: Ca(OH)2 + CO2 → CaCO3↓ + H2O,
2KOH + CO2 → K2CO3 + H2O,
KOH + CO2 → KНCO3,
2NaOH + ZnO  Na2ZnO2 + H2O↑.
Na2ZnO2 + H2O↑.
5) Растворимые в воде сильные основания взаимодействуют с некоторыми неметаллическими и металлическими простыми веществами (галогенами, фосфором, кремнием, алюминием и т.д.), например:
2KOH + Cl2 → KCl + KClO + H2O,
2KOH + 2Аl + 6H2O → 2К[Аl(ОН)4] + 3Н2.
6) Растворы щелочей взаимодействуют с растворами солей, если в результате образуются труднорастворимые основания, амфотерный гидроксид или труднорастворимая соль, например:
2NaOH + CuSO4 → Cu(OH)2↓ + Na2SO4,
2KOH + MgCl2 → Mg(OH)2↓ + 2KCl,
Ba(OH)2 + Na2SO4 → BaSO4↓ + 2NaOH.
7) Труднорастворимые в воде основания разлагаются при нагревании на основной оксид и воду, например:
2CuOH  Сu2O + H2O,
Сu2O + H2O,
Fe(OH)2  FeO + H2O.
FeO + H2O.
Основания щелочных металлов при нагревании не разлагаются, например: NaOH – не разлагается.
8) Растворимые в воде основания реагируют с амфотерными гидроксидами, реакции между твёрдыми веществами, например:
KOH + Al(OH)3  KAlO2 + 2H2O↑,
KAlO2 + 2H2O↑,
реакции в растворах, например: KOH + Al(OH)3 → К[Al(OH)4],
3KOH + Al(OH)3 → К3[Al(OH)6].
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 782; Нарушение авторских прав?; Мы поможем в написании вашей работы!