
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Номенклатура (название) кислот
|
|
|
|
Кислородные кислоты
Кислотами называются сложные вещества, состоящие из атомов водорода и кислотного остатка и дающие при диссоциации в качестве катионов только катионы водорода 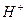 .
.
Кислоты классифицируют по следующим признакам:
1) По наличию атомов кислорода в молекуле кислоты:
− бескислородные: HF, HCl, HBr, HI, H2S и др.;
− кислородные (кислородосодержащие): H2SO4, HNO3, H3PO4, CH3COOH и др.
2) По числу ионов водорода в молекуле кислоты различают основность кислоты:
− одноосновные: HCl, HNO3, CH3COOH, HClO4, HCN и др.;
− двухосновные: H2SO4, H2CO3, H2S, H2SO3 и др.;
− трёхосновные: H3PO4, H3BO3, H3AsO4 и др.;
− четырёхосновные: H4SiO4, H4P2O7 и др.
3) По степени растворимости в воде:
− растворимые: HNO3, H2SO4, HClO, HClO4 и др.;
− труднорастворимые: H2SiO3, H4SiO4, H2MoO4 и др.
4) По степени диссоциации (α):
− сильные электролиты (α = 1): HNO3, HClO4, HMnO4, H2SO4 и др.;
− слабые электролиты (α < 1): HNO2, HClO, H2SO3 и др.
Нужно помнить ряды сильных кислот: HNO3, HClO3, HClO4, HMnO4, H2SO4, HCl, HBr, HI и др.
и слабых кислот: HNO2, HClO, HClO2, H2SO3, H2CO3, H2SiO3, H2S, HF (Н2F2), HCN, H3РO3, H3РO4, H4SiO4, CH3COOH и др.
Названия кислородосодержащих кислот производятся от названия элемента, образующего кислоту с прибавлением окончаний - ная, - вая, если степень окисления неметалла соответствует номеру группы периодической системы, где расположен неметалл. При понижении степени окисления суффикс меняется на – истая (таблица 5).
 – азот ная кислота;
– азот ная кислота;  – азот истая кислота;
– азот истая кислота;
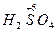 – сер ная кислота;
– сер ная кислота;  – серн истая кислота.
– серн истая кислота.
Если элемент в одной и той же степени окисления образует несколько кислородосодержащих кислот, то к названию кислоты с меньшим содержанием водородных атомов добавляется приставка «мета», при наибольшем числе – приставка «орто».
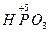 – мета фосфорная кислота;
– мета фосфорная кислота;  – орто фосфорная кислота;
– орто фосфорная кислота;
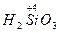 – мета кремниевая кислота;
– мета кремниевая кислота;  – орто кремниевая кислота.
– орто кремниевая кислота.
Названия бескислородных кислот производятся от названия неметалла с окончанием - о и прибавлением слова водородная:
HF – фтор о водородная; HCl – хлор о водородная; H2S – сер о водородная.
Таблица 5 – Формулы и названия наиболее употребляемых кислот и их кислотных остатков
| Кислота | Кислотный остаток | ||
| Формула | Название | Формула | Название |
| H2SO4 | Серная | HSO 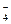
| Гидросульфат |
SO 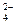
| Сульфат | ||
| HNO3 | Азотная | NO 
| Нитрат |
| HCl | Хлороводородная (соляная) | Cl- | Хлорид |
| HBr | Бромоводородная | Br 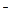
| Бромид |
| HJ | Йодоводородная | J 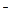
| Йодид |
| HClO3 | Хлорноватая | ClO 
| Хлорат |
| HClO4 | Хлорная | ClO 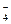
| Перхлорат |
| HMnO4 | Марганцевая | MnO 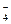
| Перманганат |
| HF | Фтороводородная (плавиковая) | F 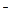
| Фторид |
| H2S | Сероводородная | HS 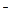
| Гидросульфид |
S 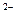
| Сульфид | ||
| H2SO3 | Сернистая | HSO 
| Гидросульфит |
SO 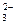
| Сульфит | ||
| HNO2 | Азотистая | NO 
| Нитрит |
| HPO3 | Метафосфорная | PO 
| Метафосфат |
| H3PO4 | Ортофосфорная | H2PO 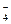
| Дигидроортофосфат |
HPO 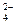
| Гидроортофосфат | ||
PO 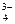
| Ортофосфат | ||
| H2CO3 | Угольная | HCO 
| Гидрокарбонат |
CO 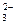
| Карбонат | ||
| H2SiO3 | Метакремнивая | HSiO 
| Гидрометасиликат |
SiO 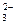
| Метасиликат | ||
| H4SiO4 | Ортокремниевая | SiO 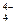
| Ортосиликат |
| H2CrO4 | Хромовая | HCrO 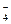
| Гидрохромат |
CrO 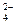
| Хромат | ||
| H2Cr2O7 | Дихромовая | HCr2O 
| Гидродихромат |
Cr2O 
| Дихромат | ||
| CH3COOH | Этановая (уксусная) | CH3COO 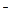
| Ацетат |
| H3BO3 | Борная (ортоборная) | BO 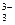
| Борат |
| HCN | Циановодородная (синильная) | CN 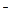
| Цианид |
| HCOOH | Метановая (муравьиная) | HCOO 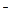
| Формиат |
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 742; Нарушение авторских прав?; Мы поможем в написании вашей работы!