
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства амфотерных оксидов. Амфотерными оксидами называют оксиды металлов, которые в зависимости от условий проявляют свойства кислотных и основных оксидов
|
|
|
|
Амфотерные оксиды
Амфотерными оксидами называют оксиды металлов, которые в зависимости от условий проявляют свойства кислотных и основных оксидов, т.е. обладают двойственными свойствами. Металлы в амфотерных оксидах находятся в промежуточных степенях окисления между высшей и низшей, чаще всего + 2, + 3, + 4, например: 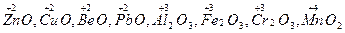 и т.д.
и т.д.
Амфотерные оксиды могут быть получены следующими способами:
1 способ: Окисление простого вещества – металла, например:
2Zn + O2 → 2ZnO.
2 способ: Термическое разложение амфотерных гидроксидов, например:
2Al(OH)3  Al2O3 + 3H2O.
Al2O3 + 3H2O.
3 способ: Термическое разложение некоторых солей, например:
(NH4)2Cr2O7  N2↑ + Cr2O3 + 4H2O,
N2↑ + Cr2O3 + 4H2O,
ZnCO3  ZnO + CO2.
ZnO + CO2.
Амфотерные оксиды – твердые вещества, труднорастворимые в воде. Они взаимодействуют:
1) с сильными основаниями (щелочами), реакции между твёрдыми веществами, например:
Al2O3 + 6NaOH  2Na3AlO3 + 3H2O↑,
2Na3AlO3 + 3H2O↑,
ортоалюминат натрия
Al2O3 + 2NaOH  2NaAlO2 + H2O↑ или
2NaAlO2 + H2O↑ или
метаалюминат натрия
реакции в растворе: Al2O3 + 2NaOH + 3H2O → 2Na[Al(OН)4(H2O)2],
диакватетрагидроксоалюминат натрия
Al2O3 + 6NaOH + 3H2O → 2Na3[Al(OН)6].
гексагидроксоалюминат натрия
2) с кислотами (кроме оксидов алюминия Al2O3 и хрома Cr2O3), например:
CuO + 2HCl → CuCl2 + H2O,
PbO + 2CH3COOH → Pb(CH3COO) + H2O.
3) с кислотными и основными оксидами, например:
ZnO + SO3 → ZnSO4,
ZnO + K2O → K2ZnO2.
4) с простыми веществами металлами и неметаллами – сильными восстановителями, (кроме Al2O3), например:
Cr2O3 + 2Al → Al2O3 + 2Cr,
CuO + C → CO + Cu.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 623; Нарушение авторских прав?; Мы поможем в написании вашей работы!