
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реакции обмена в водных растворах электролитов. Ионные реакции и уравнения
|
|
|
|
Так как молекулы электролитов в растворах распадаются на ионы, то и взаимодействия в растворах происходят между ионами.
Реакции, протекающие между ионами, называются ионными реакциями.
С участием ионов могут протекать как обменные, так и окислительно-восстановительные реакции. Рассмотрим реакции ионного обмена − взаимодействие между растворами двух солей, например:
Na2SO4 + BaCl2 → BaSO4↓ + 2NaCl
− это уравнение является молекулярным уравнением, так как формулы всех веществ записаны в виде молекул. Исходные вещества Na2SO4 и BaCl2 являются сильными электролитами; в растворе они находятся в виде ионов:
+ 2 -
Na2SO4 → 2Na + SO4;
2 + –
BaCl → Ba + 2Cl.
Сульфат бария (BaSO4) – труднорастворимая соль, выпадает в осадок, следовательно, ионы  и
и 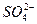 уходят из раствора в виде соединения BaSO4.
уходят из раствора в виде соединения BaSO4.
Хлорид натрия (NaCl) – растворимая соль, сильный электролит, в растворе
+ –
находится в виде ионов NaCl → Na + Cl.
С учетом диссоциации сильных электролитов уравнение реакции можно записать так:
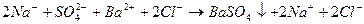 , такое уравнение называется полным ионным уравнением.
, такое уравнение называется полным ионным уравнением.
Ионы  и
и 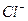 имеются и в левой, и в правой частях уравнения, т.е. эти ионы в реакции участия не принимают, их можно исключить из уравнения реакции, тогда получим:
имеются и в левой, и в правой частях уравнения, т.е. эти ионы в реакции участия не принимают, их можно исключить из уравнения реакции, тогда получим: 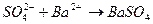 ↓ − это уравнение называется кратким ионным уравнением. Оно показывает, что в ходе данной реакции происходит взаимодействие ионов
↓ − это уравнение называется кратким ионным уравнением. Оно показывает, что в ходе данной реакции происходит взаимодействие ионов 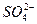 , которые находились в растворе Na2SO4, и ионов
, которые находились в растворе Na2SO4, и ионов  , которые находились в растворе BaCl2; в результате реакции образуется труднорастворимая соль BaSO4.
, которые находились в растворе BaCl2; в результате реакции образуется труднорастворимая соль BaSO4.
Необходимо помнить: в виде ионов в ионных уравнениях реакций записывают следующие соединения:
− сильные кислоты (HCl, H2SO4, HBr, HI, HClO3, HClO4, HMnO4, HNO3);
− сильные основания (KOH, NaOH, Ca(OH)2, Ba(OH)2 и др.);
− все растворимые в воде соли (смотрите таблицу растворимости).
В молекулярном виде (или в виде молекул) записывают следующие соединения
− воду (Н2О);
− слабые кислоты (HNO2, HCN, H2CO3, CH3COOH, H2SO3 и др.);
− слабые основания (NH4OH, Mg(OH)2, и др. труднорастворимые основания; смотрите таблицу растворимости);
− труднорастворимые соли (↓) (AgCl, BaSO4, CaCO3, FeS и др; смотрите таблицу растворимости);
− амфотерные гидроксиды (↓) (Al(OH)3, Zn(OH)2, Cr(OH)3 и др.);
− газообразные вещества (CO2, SO2, H2, H2S, NH3 и др.);
− оксиды металлов и неметаллов (Na2O, CaO, P2O5, SiO2, B2O3 и др.).
− простые вещества (Cu, H2, I2 и др.);
− органические вещества – неэлектролиты (C2H5OH, C6H5Br и др.).
2 КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Знание основных классов неорганических соединений, их свойств, получение, правила образования названий является необходимым условием овладения материалом неорганической химии.
Все соединения делятся на неорганические и органические соединения. В настоящее время известно около 300 тыс. неорганических соединений. Неорганические соединения делятся на две большие группы:
простые вещества;
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 3594; Нарушение авторских прав?; Мы поможем в написании вашей работы!