
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические реакции. Уравнения химических реакций
|
|
|
|
 Химические реакции это химические взаимодействия веществ. Изображение реакций при помощи химических формул и математических знаков называется химическим уравнением.
Химические реакции это химические взаимодействия веществ. Изображение реакций при помощи химических формул и математических знаков называется химическим уравнением.
При химических реакциях из атомов вступивших в реакцию веществ образуются новые вещества, и число атомов каждого элемента до реакции равно числу атомов этих элементов после реакции, т.е. в левой и в правой частях уравнения число атомов всех элементов должно быть одинаковым − закон сохранения массы веществ.
Составим уравнение реакции растворения гидроксида алюминия в избытке серной кислоты. Схема реакции:
Al(OH)3 + H2SO4 → Al2(SO4)3 + H2O.
Для составления уравнения реакции в схеме реакции необходимо подобрать коэффициенты. Подбор коэффициентов обычно начинают с формулы вещества, содержащего наибольшее число атомов элементов, независимо от того, где находится вещество – справа или слева от знака равенства. Уравниваем число атомов алюминия:
2 Al(OH)3 + H2SO4 → Al2(SO4)3 + H2O.
Уравниваем число атомов серы:
2 Al(OH)3 + 3 H2SO4 → Al2(SO4)3 + H2O.
Уравниваем число атомов водорода:
2 Al(OH)3 + 3 H2SO4 → Al2(SO4)3 + 6 H2O.
Подсчитаем число атомов кислорода в левой и правой частях уравнения реакции (проверим правильность подбора коэффициентов).
Уравнение реакции по стадиям записано для того, чтобы показать последовательность в подборе коэффициентов. На практике записывают только одну схему, которую путём подбора коэффициентов превращают в уравнение реакции.
Классификация химических реакций
Химические реакции классифицируют по следующим признакам:
1. по признаку изменения числа и состава исходных веществ и продуктов реакции делятся на следующие типы (или группы) реакций:
− реакции соединения;
− реакции разложения;
− реакции замещения;
− реакции обмена.
2. по обратимости реакции подразделяются на:
− необратимые реакции;
− обратимые реакции.
3. по тепловому эффекту реакции подразделяются на:
− экзотермические реакции;
− эндотермические реакции.
4. по изменению степеней окисления атомов элементов в ходе химической реакции подразделяются на:
− реакции без изменения степеней окисления;
− реакции с изменением степеней окисления (или окислительно-восстановительные).
Рассмотрим эти типы химических реакций.
1. Классификация по признаку изменения числа и состава исходных веществ и продуктов реакции.
Реакции соединения – это реакции, в результате которых из двух или нескольких веществ образуется одно новое вещество, например:
2H2 +O2 → 2H2O,
SO3 + H2O → H2SO4,
2Cu + O2 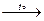 2CuO,
2CuO,
CaO + H2O → Ca(OH)2,
4NO2 + O2 + 2H2O → 4HNO3.
Реакции разложения – это реакции, в результате которых из одного сложного вещества образуется два или несколько новых веществ, например:
Ca(HCO3)2 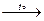 CaCO3 +CO2↑ + H2O,
CaCO3 +CO2↑ + H2O,
Zn(OH)2 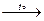 ZnO + H2O,
ZnO + H2O,
2KNO3 → 2KNO2 + O2,
CaCO3 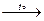 CaO + CO2↑,
CaO + CO2↑,
2AgNO3 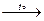 2Ag + 2NO2 + O2,
2Ag + 2NO2 + O2,
4KClO3 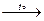 3KClO4 + KCl.
3KClO4 + KCl.
Реакции замещения – это реакции между простыми и сложными веществами, в результате которых атомы простого вещества замещают атомы сложного вещества (при составлении уравнений реакций этого типа нужно помнить о правилах замещения и пользоваться приложением В1), например:
Fe + CuSO4 → Cu + FeSO4,
Zn + 2HCl → ZnCl2 + H2↑,
Cl2 + 2KI → I2 + 2KCl,
Ca + 2H2O → Ca(OH)2 + H2↑.
Реакции обмена – это реакции между двумя сложными веществами, в результате которых два вещества обмениваются своими ионами, образуя два новых вещества. Реакции обмена протекают, если в результате обмена ионами образуются малорастворимые вещества (осадки), газообразные вещества или растворимые малодиссоциирующие вещества (слабые электролиты), например:
ВaCl2 + Na2SO4 → BaSO4↓ + 2NaCl,
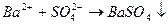 .
.
CaCO3 + 2HCl → CaCl2 + CO2 + H2O,
 ,
,
HCl + NaOH → NaCl + H2O,
 (реакция нейтрализации).
(реакция нейтрализации).
При написании ионных уравнений реакций обмена слабые электролиты, труднорастворимые и газообразные вещества записывают в недиссоциированном виде (в виде молекул).
2. Классификация по признаку обратимости
Химические реакции по признаку обратимости подразделяются на обратимые и необратимые.
Обратимые химические реакции – это химические реакции, которые одновременно протекают в двух взаимно противоположных направлениях, в прямом и обратном, например: 2SO2 + O2 ↔ 2SO3,
N2 + 3H2 ↔ 2NH3,
H2 + I2 ↔ 2HI.
Необратимые химические реакции – это химические реакции, которые протекают в одном направлении и завершаются полным превращением исходных реагирующих веществ в конечные вещества (образующиеся продукты уходят из сферы реакции – выпадают в виде осадка, выделяются в виде газа, образуются малодиссоцированные соединения или реакция сопровождается большим выделением энергии), например:
H2SO4 + 2NaOH → Na2SO4 + 2H2O,
AgNO3 + NaBr → AgBr↓ + NaNO3,
Cu + 4HNO3 → Cu(NO3)2 + 2NO2↑ +2H2O.
3. Классификация по тепловому эффекту реакции
По тепловому эффекту (Q или ∆Н; ∆Н – изменение энтальпии (теплового эффекта реакции)) химические реакции делятся на экзотермические и эндотермические.
Экзотермические химические реакции (∆Н < 0) – это химические реакции, происходящие с выделением теплоты (энергии), теплосодержание системы уменьшается, например: Fe + S → FeS, ∆Н = − 96 кДж,
С + О2 → СО2,, ∆Н = − 394 кДж.
Эндотермические химические реакции (∆Н > 0) – это химические реакции, происходящие с поглощением теплоты (энергии), теплосодержание системы возрастает, например: 2Hg → 2Hg + O2, ∆Н = + 18 кДж,
CaCO3 → CaO + CO3, ∆Н = + 1200 кДж.
Экзотермическими реакциями являются многие реакции соединения. Эндотермическими реакциями являются многие реакции разложения.
4. Классификация по признаку изменения степеней окисления атомов элементов реагирующих веществ.
Химические реакции по признаку изменения степеней окисления атомов элементов в молекулах в ходе химической реакции делятся на две группы:
1. реакции, которые протекают без изменения степеней окисления атомов элементов, например:  .
.
2. реакции, которые протекают с изменением степеней окисления атомов элементов (окислительно-восстановительные реакции), например:
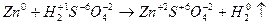 .
.
Реакции соединения с участием простых веществ, а также реакции замещения являются окислительно-восстановительными реакциями.
Реакции разложения, соединения сложных веществ могут происходить как без изменения степеней окисления элементов, так и с изменением степеней окисления атомов элементов.
Реакции обмена всегда происходят без изменения степеней окисления (таблица 2).
Таблица 2 – Примеры реакций различных типов, протекающих с изменением и без изменений степеней окисления
| Реакции | Без изменения степени окисления | Окислительно - восстановительные |
| Соединения | CaO + H2O → Ca(OH)2 Na2O + SO3 → Na2SO4 | 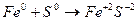
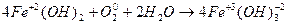
|
| Разложения | t0
 (CuOH)2CO3 2CuO +CO2+H2O
t0 (CuOH)2CO3 2CuO +CO2+H2O
t0
 Cu(OH)2 CuO + H2O Cu(OH)2 CuO + H2O
| 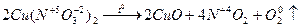 
|
| Замещения | нет | 

|
| Обмена | BaCl2 + Na2SO4 →BaSO4↓ + 2NaCl CuO + 2HNO3 → Cu(NO3)2 + H2O | нет |
Классификация химических реакций имеет большое значение в химии. Она помогает обобщать, систематизировать знания о реакциях и устанавливать закономерности их протекания.
Каждую химическую реакцию можно охарактеризовать по нескольким признакам, например: реакция 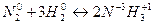 , ∆Н = − 92 кДж
, ∆Н = − 92 кДж
имеет следующие характеристики:
это реакция 1) соединения;
2) экзотермическая;
3) обратимая;
4) окислительно-восстановительная.
Вопросы и задачи для самоконтроля
1) Какой объем займут: а) 1 г водорода; б) 32 г кислорода; в) 14 г азота при нормальных условиях?
2) Вычислить массу в граммах при нормальных условиях:
а) 1 л азота; б) 8 л СО2; в) 1 м3 кислорода.
3) Какой объем займут 9,03 × 1023 молекул хлора при нормальных условиях?
4) Сколько молекул содержится в 16 г кислорода?
5) Сколько молей серной кислоты (H2SO4) содержится в 196 г её?
6) Сколько молей карбоната натрия (Na2CO3) содержится в 53 г его?
7 ) Сколько молей гидроксида натрия (NaOH) содержится в 160 г его?
8) Определить степень окисления хлора в следующих соединениях:
NaClO, NaClO2, NaClO4, CaCl2, Cl2O7, KClO3, HCl.
9) Определить степень окисления фосфора в следующих соединениях:
H3PO4, PH3, KH2PO4, K2HPO4, HPO3, H4P2O7.
10) Определить степень окисления марганца в следующих соединениях:
MnO, Mn(OH)4, KMnO4,K2MnO4, K2MnO3.
11) Какие типы химических реакций вам известны? Приведите примеры.
12) Какая реакция: соединения, разложения, замещения или обмена происходит при образовании воды:
а) в результате горения водорода на воздухе;
б) в результате взаимодействия водорода с оксидом меди (II);
в) в результате нагревания гидроксида железа (III);
г) при взаимодействии гидрокарбоната калия с гидроксидом калия.
13) Закончите уравнения реакций, расставьте коэффициенты и назовите, к какому типу относятся данные уравнения реакций, запишите уравнения реакций между электролитами в ионном виде:
| 1) Al + O2 → _____________________ | 5) Cr(OH)3 +NaOH → _____________ |
2) Cr(OH)3  _________________ _________________
| 6) Na2S + HCl → _________________ |
| 3) Cu + AgNO3 → _________________ | 7) FeCl2 + NaOH → _______________ |
| 4) Pb(NO3)2 + KI → _______________ | 8) H2SO4 +NaOH → _______________ |
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 4624; Нарушение авторских прав?; Мы поможем в написании вашей работы!