
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные оксиды
|
|
|
|
Оксиды
Сложные вещества.
Простыми веществами называются вещества, молекулы которых состоят из атомов одного и того же элемента. Условные формулы простых веществ, состоят из одного атома элемента, например: С (углерод), из двух атомов элемента Н2 (водород), из трёх атомов элемента О3 (озон), из восьми атомов элемента S8 (сера) и т.д. Все простые вещества подразделяются на металлические и неметаллические вещества.
Металлическими веществами называются простые вещества, которые в химических реакциях проявляют свойства восстановителей (или восстановительные свойства), отдавая электроны, например: К, Fe, Zn и т.д.
Нужно помнить, что в химии есть исключения, например: Sn (олово) и Pb (свинец) могут принимать и отдавать электроны, они называются амфигенами.
Неметаллическими веществами называются простые вещества, которые в химических реакциях проявляют свойства, как окислителя, так и восстановителя, т.е. они способны как принимать, так и отдавать электроны (кроме простых веществ, образованных атомами элементов главной подгруппы восьмой группы).
Сложными веществами называют вещества, молекулы которых состоят из атомов двух или более элементов, например: H2O (из атомов двух элементов), H2SO4 (из атомов трёх элементов), KHCO3, KAl(SO4)2 (из атомов четырёх элементов) и т.д.
Сложные вещества делятся на четыре группы: оксиды, гидроксиды, соли, бинарные соединения.
Оксидами называются сложные вещества, молекулы которых состоят из атомов двух элементов, один из которых кислород в степени окисления (– 2), например: H2O, CuO, SO2 (при определении степени окисления знак «+» или «–» ставится перед цифрой, а при определении заряда, иона – после цифры).

 Оксиды
Оксиды 


 Солеобразующие Несолеобразующие
Солеобразующие Несолеобразующие
Основные Амфотерные
Кислотные
Оксиды делятся на две группы:
1) несолеобразующие (безразличные или индифферентные);
2) солеобразующие.
Несолеобразующие – оксиды, которые при химических реакциях не образуют солей и образованы неметаллическими элементами в низших степенях окисления, например: N2O – оксид азота (I), NO – оксид азота (II), СO – оксид углерода (II).
Солеобразующие – оксиды, которые при химических реакциях образуют соли. Они подразделяются на три группы:
1) основные оксиды;
2) кислотные оксиды;
3) амфотерные оксиды.
Номенклатура (название) оксидов: Название оксида образуется из слова оксид и русского названия элемента в родительном падеже. Если элемент имеет переменную степень окисления и образует несколько оксидов, то в их названии указывается степень окисления римской цифрой в скобках после названия. Например: FeO – оксид железа (II), N2O – оксид азота (I), MnO2 – оксид марганца (IV) и т.д.
Основными оксидами называют оксиды, которым соответствуют основания – 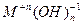 . Основные оксиды образуются только металлическими элементами в низших степенях окисления (+1, +2), например:
. Основные оксиды образуются только металлическими элементами в низших степенях окисления (+1, +2), например:  ;
; 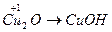 ;
; 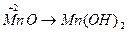 ;
; 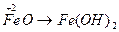 ;
; 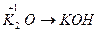 ;
; 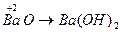 ;
;  и т.д. Основные оксиды могут быть получены несколькими способами.
и т.д. Основные оксиды могут быть получены несколькими способами.
1 способ: Окисление простого вещества – металла кислородом
2Li + O2 → 2Li2O,
2Ca + O2 → 2CaO.
Этот способ неприемлим для щелочных металлов (за исключением лития), которые при окислении образуют пероксиды или супероксиды, например:
2Na + O2 → Na2O2,
2К + 2О2 → К2О4.
Оксид натрия можно получить восстановлением Na2O2 металлическим натрием:
Na2O2 +2Na → 2Na2O.
2 способ: Термическое разложение оснований (кроме оснований щелочных металлов), например: Mg(OH)2  MgO + H2O.
MgO + H2O.
3 способ: Разложение некоторых солей, например, карбонатов (кроме карбонатов щелочных металлов), например:
CaCO3  CaO + CO2.
CaO + CO2.
4 способ: Окисление (обжиг) сульфидов металлов:
2MnS + 3O2 → 2MnO + 2SO2.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 1201; Нарушение авторских прав?; Мы поможем в написании вашей работы!