
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Степень окисления
|
|
|
|
Понятие степень окисления введено для характеристики состояния атома в соединении. При определении этого понятия условно предполагают, что в соединении валентные электроны полностью перешли к более электроотрицательным атомам, а потому соединения состоят только из положительно и отрицательно заряженных ионов. В действительности же при образовании большинства соединений происходит не отдача электронов, а только смещение электронной пары в молекуле к более электроотрицательному атому или точнее, связующего электронного облака от одного атома к другому.
Степень окисления – это условный заряд, который приписывается атому, исходя их предположения, что соединение состоит только из ионов, и при этом электронейтрально.
Степень окисления определяется числом полностью смещенных электронов от одного элемента к другому в соединении. В простых веществах отсутствует какое – либо смещение электронов, поэтому степень окисления элементов в простых веществах считается равной нулю, например: 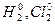 и т.д.
и т.д.
При определении степени окисления атомов в сложных соединениях,
нужно помнить:
1) степень окисления водорода в соединениях со всеми элементами равна (+1), кроме солеобразующих гидридов щелочных и щелочноземельных металлов 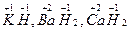 и т.д., где степень окисления водорода равна (− 1);
и т.д., где степень окисления водорода равна (− 1);
2) степень окисления кислорода в большинстве соединений равна (− 2), за исключением соединения кислорода с фтором 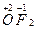 , в котором степень окисления кислорода (+ 2) – фторид кислорода; пероксидов
, в котором степень окисления кислорода (+ 2) – фторид кислорода; пероксидов 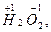 супероксидов
супероксидов 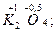
3) степень окисления фтора во всех сложных соединениях равна (− 1);
4) высшая положительная степеньокисления элементов равна номеру группы периодической системы, в которой находится элемент, например: 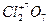 ;
; 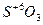 ;
; 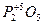 ;
; 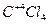 и др. (кроме следующих элементов: Cu; Ag; Au; O; F; He; Ne; Ar; Fe; Co; Ni; Pd; Pt и некоторые другие).
и др. (кроме следующих элементов: Cu; Ag; Au; O; F; He; Ne; Ar; Fe; Co; Ni; Pd; Pt и некоторые другие).
5) низшая отрицательнаястепень окисления элементов характерна только для элементов главных подгрупп IV − VII групп и водорода 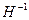 . Низшая отрицательная степень окисления этих элементов рассчитывается по формуле:
. Низшая отрицательная степень окисления этих элементов рассчитывается по формуле:
номер группы, в которой находится элемент, минус 8.
Например, сера находится в шестой группе периодической системы Д.И. Менделеева и низшая степень окисления серы: 6 – 8 = – 2.
6) степень окисления атомов элементов определяют по молекулярной формуле, считая, что алгебраическая сумма степеней окисления атомов в соединении равна нулю, а в сложном ионе – заряду иона.
Примеры: а) Вычислить степень окисления хрома в хромовой кислоте H2CrO4.
Обозначим степень окисления хрома через Х, так как сумма всех степеней окисления в соединении должна быть равной нулю, то умножим известные степени окисления водорода (+ 1) и кислорода (– 2) на число их атомов в соединении, просуммируем степени окисления всех атомов в молекуле, составим уравнение: (+ 1) ∙ 2 + Х · 1 + (– 2) ∙ 4 = 0, отсюда Х = +6.
б) Вычислить степень окисления фосфора в соли ортофосфата натрия Na3PO4.
Обозначим степень окисления фосфора через Х, так как сумма всех степеней окисления в соединении должна быть равной нулю, то умножим степень окисления натрия (+ 1) и кислорода (– 2) на число их атомов в соединении, просуммируем степени окисления всех атомов в молекуле, составим уравнение:
(+ 1) ∙ 3 + Х · 1 + (– 2) ∙ 4 = 0, отсюда Х = +5.
в) Вычислить степень окисления атома серы в ионе 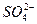 .
.
Обозначим степень окисления атома серы через Х, так как сумма всех степеней окисления в соединении должна быть равной заряду иона, т.е. – 2, то умножим степень окисления кислорода (– 2) на число их атомов в ионе 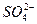 , просуммируем степени окисления всех атомов в молекуле, составим уравнение:
, просуммируем степени окисления всех атомов в молекуле, составим уравнение:
(Х) · 1 + (– 2) ∙ 4 = – 2, отсюда Х = +6.
Таким образом, чтобы определить степень окисления элемента по формуле иона, нужно степень окисления элемента обозначить через Х. Записать значения степеней окисления атомов всех элементов в формуле иона, просуммировать значения степеней окисления атомов всех элементов, сумму приравнять к величине заряда иона (так как любой ион имеет определенный заряд) и решить уравнение с одним неизвестным.
Задача 1. Определить степень окисления хрома в соединении 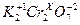 .
.
2 ∙ (+1) + 2 ∙ (Х) + 7 ∙ (− 2) = 0,
2Х = 14 − 2,
2Х = + 12,
Х = + 6.
Таким образом, чтобы определить степень окисления элемента по молекулярной формуле, нужно степень окисления элемента обозначить через Х. Записать значения степеней окисления атомов всех элементов в молекулярной формуле, просуммировать значения степеней окисления атомов всех элементов, сумму приравнять к нулю (так как молекула любого вещества электронейтральна) и решить уравнение с одним неизвестным.
Ответ: степень окисления хрома в соединении равна + 6.
Любая молекула является электронейтральной, поэтому алгебраическая сумма степеней окисления всех атомов в молекуле всегда равна нулю.
Чтобы составить химическую формулу соединения, необходимо знать степени окисления атомов элементов, образующих это соединение. Степень окисления некоторых важнейших элементов приводятся в таблице 1.
Таблица 1 – Степени окисления важнейших элементов
| Степень окисления | Элементы | Примеры формул кислородных соединений |
| Элементы с постоянной степенью окисления | ||
| +1 | Li, Na, K, Rb, Cs, F | Li2O, K2O |
| +2 | O, Be, Mg, Ca, Ba, Zn, Sr | MgO, ZnO |
| +3 | Al | Al2O3 |
| Элементы с переменной степенью окисления | ||
| +1, +2, +3 | Cu | Cu2O, CuО, KCuO2 |
| +2, +3, +6 | Fe | FeO, Fe2O3, K2FeO4 |
| +2, +4, −4 | C, Sn, Pb | CO, CO2, CH4 |
| +3, +5, −3 | P, Sb, N | P2O3, P2O5, PH3 |
| +2, +3, +6 | Cr | CrO, Cr2O3, CrO3 |
| +2, +4, +6, −2 | S, Se | SО, SO2, SO3, H2S |
| +2, +3, +4, +6,+7 | Mn | MnO, Mn2O3, MnO2, MnO3, Mn2O7 |
| +1, +3, +5, +7, −1 | Cl, Br, I | Cl2O, Cl2O3, Cl2O5, Cl2O7, HCl |
| +1, −1 | H | H2O, NaH |
Основное правило, согласно которому составляются формулы соединений, молекулы которых состоят из атомов двух элементов, состоит в том, что произведение степени окисления атомов одного элемента на число атомов этого элемента должно быть равно произведению степени окисления атомов второго элемента на число атомов второго элемента. Согласно этому правилу надо найти наименьшее общее кратное степеней окисления обоих элементов и частное от деления его на степень окисления каждого элемента даст число атомов этих элементов в молекуле.
Например, нужно найти формулу соединения марганца с кислородом, зная, что марганец имеет степень окисления + 7, а кислород – 2. Наименьшее кратное степеней окисления равно 14, делением его на степени окисления элементов получим искомую формулу вещества – 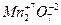 .
.
Подобным же образом поступают при составлении молекулярных формул кислот, оснований, солей.
Знание степеней окисления элементов позволяет делать выводы о химических свойствах веществ, в состав которых входят эти элементы.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 1933; Нарушение авторских прав?; Мы поможем в написании вашей работы!