
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
По формуле оксида определить число атомов элемента образующего оксид и число атомов кислорода
|
|
|
|
Определить степень окисления элемента образующего оксид.
Определяем степень окисления элемента, образующего оксид, помня, что степень окисления атома кислорода в оксидах равна -2, а молекула любого вещества электронейтральна (ее заряд равен 0).
Над символами атомов элементов в формуле вещества расставим степени окисления атомов элементов. Так как степень окисления атома железа не известна, то обозначим ее через Х, тогда:
Х - 2
Fe2O3
Запишем сумму степеней окисления атомов всех элементов, приравняем ее к нулю (молекула любого вещества электронейтральна).
Х - 2
Fe2O3
2 × Х + 3 × (- 2) = 0
Решим уравнение с одним неизвестным:
2Х - 6 = 0,
Х = + 6/2 = + 3.
В молекуле Fe2O3 два атома железа и три атома кислорода.
3). Определить молярную массу оксида:
М(Fe2O3) = 2А(Fe) + 3А(О) = 2 × 55,85 + 3 × 16 = 111,7 + 48 = 159,7 г/моль.
4). Рассчитать М экв (оксида):
М(оксида)
 В формулу Мэкв.(в-ва) = или
В формулу Мэкв.(в-ва) = или
Степень окисления элемента × Число атомов элемента
М(оксида)
 Мэкв.(в-ва) =
Мэкв.(в-ва) =
В × С
подставляем найденные в пунктах 1, 2, 3 значения:
159,7
 Мэкв.(Fe2O3) = = 26,61 г/моль.
Мэкв.(Fe2O3) = = 26,61 г/моль.
3 × 2
Ответ: Мэкв.(Fe2O3) = 26,61 г/моль.
Эквивалентную массу оксида можно рассчитать и по эквивалентным массам элемента, образующего оксид и кислорода:
Мэкв.(оксида) = Мэкв.(Эл.) + Мэкв.(О),
где Эл. – элемент, образующий оксид.
55,85
 Мэкв.(Fe) = = 18,61 г/моль;
Мэкв.(Fe) = = 18,61 г/моль;
3
16
 Мэкв.(O) = = 8 г/моль;
Мэкв.(O) = = 8 г/моль;
2
Мэкв.(Fe2O3) = Мэкв.(Fe) + Мэкв.(O) = 18,61 + 8 = 26,61 г/моль.
Ответ: Мэкв.(Fe2O3) = 26,61 г/моль.
5). Для других сложных веществ:
М(в-ва)
 Мэкв.(в-ва) =,
Мэкв.(в-ва) =,
Фn
где М(в-ва) – молярная масса вещества;
Фn – заряд функциональной группы;
n – число функциональных групп в молекуле вещества, участвующих в химической реакции.
Функциональной группы кислот является ион водорода, оснований – гидроксид-ион, солей – катион металла.
Рассчитаем молярные массы эквивалентов H3PO4; Ba(OH)2 и Cr2(SO4)3
+ – 3+
при помощи участия ионов Н – кислот; ОН – основания и Cr – соли в реакциях
+ __ 3+
полного обмена ионов Н – кислот; ОН – основания и Cr:
М(H3PO4) 98

 Мэкв.(H3PO4) = = = 32,66 г/моль;
Мэкв.(H3PO4) = = = 32,66 г/моль;
Фn 3 × 1
М(Ва(ОН)2) 171,33

 Мэкв.(Ва(ОН)2) = = = 85,66 г/моль;
Мэкв.(Ва(ОН)2) = = = 85,66 г/моль;
Фn 2 × 1
М(Cr2(SО4)3) 392

 Мэкв.(Cr2(SО4)3) = = = 65,33 г/моль;
Мэкв.(Cr2(SО4)3) = = = 65,33 г/моль;
Фn 3 × 2
В любой химической реакции один эквивалент одного реагирующего вещества взаимодействует с одним эквивалентом другого вещества, образуя эквивалентные количества продуктов реакции.
В результате работ И.В. Рихтера (1792 – 1800 гг.) был открыт закон эквивалентов: массы взаимодействующих веществ прямо пропорциональны их химическим эквивалентам.
Для количественных расчетов используется закон эквивалентов: массы реагирующих и образующихся веществ относятся друг к другу, как их эквивалентные массы, т.е.все вещества реагируют друг с другом в эквивалентных количествах в соответствии с законом эквивалентов.
Математическое выражение закона эквивалентов имеет следующий вид:
m1 = mэкв (1) или m1 = m2
m2 mэкв(2) mэкв (1) mэкв (2)
где m1 и m2 – массы реагирующих или образующихся веществ;
mэкв(1) и mэкв(2) – эквивалентные массы этих веществ.
Пример: Определите массу карбоната натрия Na2CO3, необходимую для полной нейтрализации 1,96 кг серной кислоты H2SO4.
Решение: воспользуемся законом эквивалентов m(Na2CO3) = mэкв (Na2CO3)
m(H2SO4) mэкв(H2SO4)
определяем эквивалентные массы веществ, исходя из их химических формул:
mэкв(Na2CO3) = 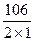 = 53 г/моль;
= 53 г/моль;
mэкв(H2SO4) = 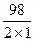 = 49 г/моль, тогда
= 49 г/моль, тогда
Х = 53 г/моль, отсюда Х = 2,12 кг.
1,96 кг 49 г/моль
Например: в реакции HCl + KOH → KCl + H2O один эквивалент HCl реагирует с одним эквивалентом KOH с образованием по одному эквиваленту KCl и H2O. На основании молярной массы эквивалентов можно записать следующее выражение:
m(HCl) = Э(KCl) . .
m(KOH) Э(H2O)
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 2802; Нарушение авторских прав?; Мы поможем в написании вашей работы!