
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химический эквивалент
|
|
|
|
В химии широко используются понятия химический эквивалент (Э) (эквивалент), моль эквивалентов, молярная масса эквивалентов вещества (Мэкв.).
Химический эквивалент (Э) – реальная или условная частица, соответствующая одному иону водорода в кислотно-основных или ионообменных реакциях или одному электрону в окислительно-восстановительных реакциях. Её состав выражают с помощью химических формул и символов. Эквивалент безразмерная величина. При определении эквивалента вещества необходимо исходить из конкретной реакции, в которой участвует конкретное вещество. Определим эквиваленты КОН и Са(ОН)2 в следующих реакциях:
КОН + HCl → KCl + H2O (1)
1 молекула 1 молекула
– +
Ионное уравнение: ОН + Н → H2O
Из ионного уравнения реакции следует, что одному иону водорода соответствует один гидроксид-ион, входящий в состав одной молекулы КОН, поэтому Э(КОН) = КОН следовательно, 1 эквивалент КОН совпадает с его формульной единицей (ФЕ) – 1ФЕ КОН.
В молекуле гидроксида кальция Са(ОН)2 два гидроксид-иона.
Нужно помнить, что в реакциях замещения происходит постепенное замещение одноименно заряженных ионов. Поэтому при взаимодействии Са(ОН)2 с HCl возможно протекании реакции нейтрализации по двум направлениям:
1). частичная нейтрализация Са(ОН)2
Са(ОН)2 + HCl → Са(ОН)Cl + H2O (2)
1 молекула 1 молекула
В реакции обмена участвует один гидроксид-ион Са(ОН)2. Он соответствует одному иону водорода молекулы HCl. Поэтому один эквивалент Са(ОН)2 соответствует одной формульной единице:
Э(Са(ОН)2) = 1ФЕ(Са(ОН)2)
 1 моль Са(ОН)2 1 эквивалент
1 моль Са(ОН)2 1 эквивалент
2). полная нейтрализация Са(ОН)2
Са(ОН)2 + 2HCl → СаCl2 + H2O (3)
1 молекула 2 молекулы
В реакции обмена участвует два гидроксид-иона Са(ОН)2. Они соответствуют двум ионам водорода двух молекул HCl, следовательно, в одной формульной единице Са(ОН)2 содержится 2 эквивалента Са(ОН)2:
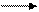 1 моль Са(ОН)2 2 эквивалента
1 моль Са(ОН)2 2 эквивалента
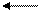 1/2 Са(ОН)2 1 эквивалент
1/2 Са(ОН)2 1 эквивалент
В данном случае, в одной формульной единице Са(ОН)2 содержится два эквивалента Са(ОН)2, таким образом 1 экв. Са(ОН)2 = 1/2 ФЕ(Са(ОН)2).
Из рассмотренных уравнений реакций нейтрализации раствора Са(ОН)2 раствором HCl видно, что эквивалент вещества может быть переменной величиной.
Число, обозначающее, какая доля реальной частицы эквивалентна одному иону водорода в кислотно-основных (ионообменных) реакциях или одному электрону в окислительно-восстановительных реакциях, называется фактором эквивалентности (fэкв.).
В рассмотренных выше примерах fэкв.(КОН) = 1,
в реакции (2) fэкв.(Са(ОН)2) = 1,
а в реакции (3) fэкв.(Са(ОН)2) = 1/2.
Единицей измерения количества вещества эквивалентов является моль.
Моль эквивалентов – количество вещества, содержащего 6,02 × 1023 эквивалентов.
Количество вещества эквивалентов обозначается символом nэкв.(в-ва) и представляет собой физическую величину, пропорциональную числу эквивалентов вещества (в-ва):
Nэкв.(в-ва)
 nэкв.(в-ва) =,
nэкв.(в-ва) =,
NA
где Nэкв.(в-ва) – число эквивалентов вещества;
NA – число Авогадро.
Количество вещества эквивалентов измеряется в молях.
Молярная масса эквивалентов вещества (Мэкв.) – это масса одного моля эквивалентов вещества.
Единицей измерения молярной массы эквивалентов является г/моль. Молярные массы эквивалентов можно рассчитать, если известны молярные массы веществ и их фактор эквивалентности, по формуле
Мэкв.(в-ва) = М(в-ва) × fэкв.(в-ва),
где М(в-ва) – молярная масса данного вещества;
fэкв.(в-ва) – фактор эквивалентности вещества.
Фактор эквивалентности вещества рассчитывают по следующим формулам:
1;
fэкв  . (кислоты) =
. (кислоты) =  число ионов
число ионов  в молекуле кислоты, участвующих в химической реакции
в молекуле кислоты, участвующих в химической реакции
+
Пример: В молекуле серной кислоты Н2SO4 максимальное число ионов Н равно двум:
+

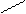
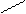
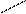
 Н О О
Н О О
+ S



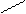
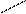
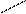
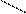 Н
Н 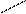 О О, поэтому при полной нейтрализации кислоты
О О, поэтому при полной нейтрализации кислоты
fэкв  . (Н2SO4) = 1/2.
. (Н2SO4) = 1/2.
В молекуле фосфористой кислоты Н3РО3, имеющей следующее строение:
+

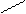
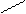
 Н О О
Н О О
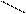 + Р
+ Р

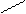 Н О Н, тоже два иона водорода,
Н О Н, тоже два иона водорода,
поэтому при полной нейтрализации кислоты:
fэкв  . (Н3РO3) = 1/2.
. (Н3РO3) = 1/2.
В молекуле уксусной (этановой) кислоты СН3СООН, имеющей строение
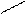
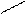 О +
О +
СН3С – О – Н, один ион водорода, поэтому
fэкв  . (СН3СОOН) = 1/1 = 1.
. (СН3СОOН) = 1/1 = 1.
Фактор эквивалентности оснований и амфотерных гидроксидов, проявляющих свойства оснований рассчитывается по формуле:

 1;
1;
fэкв  (основания) =
(основания) =  число ионов
число ионов 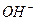 в молекуле основания, участвующих в химической реакции
в молекуле основания, участвующих в химической реакции
Пример: В молекуле Fe(OH)2 два гидроксид-иона. При полной нейтрализации основания Fe(OH)2 его фактор эквивалентности равен:
fэкв  Fe(OН)2 = 1/2.
Fe(OН)2 = 1/2.
Фактор эквивалентности соли рассчитывается по формуле:
 1 .
1 .
fэкв  . (соли) =
. (соли) =  число ионов металла в молекуле соли умноженное на заряд иона металла
число ионов металла в молекуле соли умноженное на заряд иона металла
Пример: В молекуле соли Cr2(SO4)3 число ионов хрома равно двум, а заряд иона хрома + 3, тогда
1 1

 fэкв
fэкв  (Cr2(SO4)3) = =.
(Cr2(SO4)3) = =.
2 × 3 6
Используя математические выражения Мэкв.(в-ва) = М(в-ва) × fэкв.(в-ва),
рассчитаем молярные массы эквивалентов в уравнениях реакций (1) – (3):
1). Мэкв.(КОН) = М(КОН) × fэкв.(КОН) = 56 × 1 = 56 г/моль;
2). Мэкв.(Са(ОН)2) = М(Са(ОН)2) × fэкв.(Са(ОН)2) = 74 × 1 = 74 г/моль;
3). Мэкв.(Са(ОН)2) = М(Са(ОН)2) × fэкв.(Са(ОН)2) = 74 × 1/2 = 37 г/моль.
Таким образом, молярная масса эквивалентов одного и того же вещества могут иметь различные значения.
Для расчета молярной массы эквивалентов различных типов веществ используют следующие математические выражения:
1). Для простого вещества:
Ма
 Мэкв.(в-ва) =,
Мэкв.(в-ва) =,
В
где Ма – молярная масса атома данного простого вещества;
В – степень окисления атома.
2). Для оксидов:
Эквивалент оксидов равен сумме молярных масс эквивалентов атома элемента и атома кислорода и определяется по формуле:
М(оксида)
 Мэкв.(в-ва) =,
Мэкв.(в-ва) =,
В × С
где М – молярная масса оксида;
В – степень окисления элемента в оксиде;
С – число атомов элемента в оксиде.
Пример: Рассчитаем Мэкв.(Fe2O3).
Алгоритм решения:
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 12970; Нарушение авторских прав?; Мы поможем в написании вашей работы!