
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Способы получения средних солей
|
|
|
|
Номенклатура (название) средних солей
Название средних солей складывается из названия аниона кислоты в именительном падеже и катиона металла в родительном падеже, например: Al2(SO4)3 – сульфат алюминия, KI – иодид калия, CaCO3 – карбонат кальция и т.д. Если металл имеет переменную степень окисления, то она указывается после названия металла римской цифрой в скобках, например: FeCl2 – хлорид железа (II), FeCl3 – хлорид железа (III).
Нужно помнить, что в молекуле средней соли сумма степеней окисления атомов металла, равна сумме зарядов анионов кислоты.
Рассмотрим основные способы получения средних солей.
1. Взаимодействие оснований и амфотерных гидроксидов с кислотами:
NaOH + HCl → NaCl + H2O,
Ba(OH)2 + H2SO4 → BaSO4 + 2H2O,
Zn(OH)2 + 2HNO3 → Zn(NO3)2 + 2H2O.
2. Взаимодействие оснований с кислотными оксидами:
Ca(OH)2 + CO2 → CaCO3 + H2O,
2NH4OH + SO3 → (NH4)2SO4 + H2O.
3. Взаимодействие основных и амфотерных оксидов с кислотами:
BaO + H2SO4 → BaSO4 + H2O,
CuO + 2HNO3 → Cu(NO3)2 + H2O.
4. Взаимодействие основных и амфотерных оксидов с кислотными и амфотерными оксидами:
CaO + CO2 → CaCO3,
ZnO + SO3 → ZnSO4,
K2O + Al2O3 → 2KAlO2.
5. Взаимодействие растворимых оснований (щелочей) с солями:
2KOH+ FeSO4 → K2SO4 + Fe(OH)2.
6. Взаимодействие солей с кислотами (смотрите ряд активности кислот, помните о ряде активности кислот ):
AgNO3 + HCl → AgCl↓ + HNO3,
BaCl2 + H2SO4 → BaSO4↓ + 2HCl.
7. Взаимодействие двух различных растворимых солей между собой (если образуется труднорастворимая соль):
AgNO3 + NaCl → AgCl↓ + NaNO3,
Na2CO3 + BaCl2 → BaCO3↓ + 2NaCl,
BaCl2 + K2SO4 → BaSO4↓ + 2KCl.
8. Взаимодействие металлов с кислотами. Водород выделяется при взаимодействии активных металлов с разбавленными растворами кислот, кроме азотной кислоты HNO3 и концентрированной серной кислоты H2SO4:
Mg + H2SO3 → MgSO3 + H2↑,
(разб)
Zn + 2HCl → ZnCl2 + H2↑.
9. Взаимодействие активных металлов с солями менее активных металлов (смотри ряд напряжений (активности) металлов):
Cu + HgCl2 → CuCl2 + Hg,
Zn + Cu(NO3)2 → Zn(NO3)2 + Cu,
Fe + CuCl2 → FeCl2 + Cu.
10. Взаимодействие металлов с неметаллами:
2Fe + 3Cl2  2FeCl3,
2FeCl3,
Fe + S  FeS,
FeS,
2Na + Cl2 → 2NaCl.
Кроме этих общих способов получения солей возможны и некоторые частные способы:
1. Сплавление солей с некоторыми кислотными оксидами, например:
K2CO3 + SiO2  K2SiO3 + CO2↑.
K2SiO3 + CO2↑.
2. Взаимодействие растворимых оснований (щелочей) с галогенами, и некоторыми другими простыми неметаллическими веществами, например:
Cl2 + 2KOH 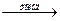 KCl + KClO + H2O;
KCl + KClO + H2O;
3Cl2 + 6KOH 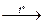 5KCl + KClO3 + 3H2O;
5KCl + KClO3 + 3H2O;
Br2 + 2NaOH → NaBr + NaBrO + H2O.
3. Взаимодействие активных галогенов с солями менее активных галогенов галогенсодержащих кислот. Окислительная активность галогенов уменьшается в ряду: F2, Cl2, Br2, J2: 2KBr + Cl2 → 2KCl + Br2,
2NaJ + Br2 → 2NaBr + J2.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 776; Нарушение авторских прав?; Мы поможем в написании вашей работы!