
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства основных солей
|
|
|
|
Способы получения основных солей
Номенклатура (название) основных солей
Название основных солей складывается из названия аниона в именительном падеже с добавлением приставки – гидроксо и названия металла с указанием его степени окисления римской цифрой в скобках, если он имеет переменную степень окисления, например: AlOHCl2 − гидроксидхлорида алюминия, (CuOH)2CO3 − гидроксидкарбоната меди (II), FeOHSO4 − гидроксидсульфата железа (III). При содержании в основной соли двух гидроксогрупп употребляется приставка – дигидроксо, например: Fe(OH)2Cl − дигидроксидхлорида железа (III).
Основные соли образуются:
1) при добавлении недостатка раствора щелочи к растворам средних солей металлов, образованных труднорастворимыми основаниями или амфотерными гидроксидами, например:
AlCl3 + NaOH → AlOHCl2 +NaCl.
2) при действии растворов солей слабых кислородных кислот на средние соли, например:
2MgCl2 + 2K2CO3 + H2O → (MgOH)2CO3 + CO2 + 4KCl.
3) при действии недостатка кислоты на многокислотные основания или амфотерные гидроксиды, например:
Fе(OH)3 + 2HNO3 → FеOH(NO3)2 + 2H2O.
1.Диссоциация основных солей.
Нужно помнить: основные соли диссоциируют по ступеням: по первой ступени необратимо (по типу сильного электролита) с образованием гидроксокатиона и кислотных остатков; по всем остальным ступеням обратимо с постепенным отщеплением ионов 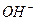 от гидроксокатиона. Примеры диссоциации основных солей:
от гидроксокатиона. Примеры диссоциации основных солей:
1ступень:  ,
,
гидроксокатион
2 ступень: 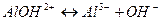 .
.
1 ступень:  ,
,
гидроксокатион
2 ступень:  .
.
1 ступень: 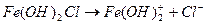 ,
,
гидроксокатион
2 ступень:  ,
,
гидроксокатион
3 ступень:  .
.
2. Основные соли летучих кислородных кислот при нагревании легко разлагаются, например:
(CuOH)2CO3 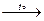 2CuО + CO2↑ + H2O.
2CuО + CO2↑ + H2O.
3. Реагируют с кислотами, например:
(MgOH)2CO3 + 2H2SO4 → 2MgSO4 + CO2 + 3H2O,
CuOHCl + HCl → CuCl2 + H2O,
FeOH(NO3)2 + HNO3 → Fe(NO3)3 + H2O.
4. Реагируют со щелочами, например:
Fe(OH)NO3 + КOH → Fe(OH)2 + КNO3. 
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 15700; Нарушение авторских прав?; Мы поможем в написании вашей работы!