
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства средних солей
|
|
|
|
1. Диссоциация средних солей.
Нужно помнить, что средние соли диссоциируют необратимо по типу сильного электролита, в одну ступень с образованием всех ионов, входящих в состав соли, например:
Al2(SO4)3 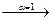 2Al3+ + 3SO
2Al3+ + 3SO 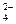 ,
,
K3PO4 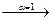 3K+ + PO
3K+ + PO 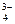 ,
,
Cu(NO3)2 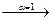 Cu2+ + 2NO
Cu2+ + 2NO  ,
,
CH3COONH4 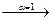 CH3COO- + NH
CH3COO- + NH 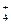 .
.
2. Соли взаимодействуют с металлами с образованием новой соли и нового металла. Данный металл может вытеснять из раствора соли только те металлы, которые находятся правее его в электрохимическом ряду напряжений, где М(1) более активный металл, чем М(2). Например: реакция взаимодействия раствора сульфата меди (II) с металлическим железом идет с выделением металлической меди: CuSO4 + Fe → FeSO4 + Cu.
Железо вытесняет медь из раствора соли меди, потому что железо – более активный металл, чем медь (смотри ряд напряжений (активности) металлов).
3. Растворы солей взаимодействуют со щелочами с образованием новой соли и нового труднорастворимого основания или труднорастворимой соли, например:
FeCl3 + 3KOH → Fe(OH)3↓ + 3KCl,
CuSO4 +NaOH → Cu(OH)2↓ + NaSO4,
K2CO3 + Ba(OH)2 → BaCO3↓ + 2KOH.
Реакции могут протекать с образованием основных солей, например:
FeCl3 + KOH → Fe(OH)Cl2 + KCl,
FeCl3 + 2KOH → Fe(OH)2Cl + 2KCl.
4. Соли взаимодействуют с кислотами с образованием новой более слабой кислоты (смотрите ряд активности кислот) или новой труднорастворимой соли, например: BaCl2 + H2SO4 → BaSO4↓ + 2HCl,
 CO2
CO2

 Na2CO3 + 2HCl → 2NaCl + H2CO3
Na2CO3 + 2HCl → 2NaCl + H2CO3
H2O.
5. Соли взаимодействуют между собой с образованием новых солей, если одна из солей выпадает в осадок, например:
AgNO3 + KCl → AgCl↓ + KNO3.
6. Некоторые соли разлагаются при нагревании, например:
MgCO3 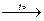 MgO + CO2↑,
MgO + CO2↑,
(NH4)2Cr2O7 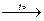 N2↑ + Cr2O3 + 4H2O,
N2↑ + Cr2O3 + 4H2O,
KNO3 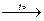 KNO2 + O2↑.
KNO2 + O2↑.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 859; Нарушение авторских прав?; Мы поможем в написании вашей работы!