
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Номенклатура (название) кислых солей
|
|
|
|
Кислые соли
Кислые соли – это продукты неполного замещения катионов водорода в молекулах многоосновных кислот на катионы металла.
Например: KHCO3 – гидрокарбонат калия, NaHSO4 – гидросульфат натрия и т.д. В кислых солях, кроме ионов металла и кислотного остатка содержаться ионы водорода (H+).
Двухосновная кислота с любым металлом образует одну нормальную и одну кислую соль.
H2SO4 + NaOH → NaHSO4 + H2O
Трёхосновная кислота с любым металлом образует одну нормальную и две кислые соли:

Название кислых солей складывается из названия аниона кислоты с добавлением приставки – гидро (с латинского названия «гидрогениум») и названия металла в родительном падеже, например: Ca(HCO3)2 – гидрокарбонат кальция, NaHS – гидросульфид натрия, FeHPO4 – гидроортофосфат железа (II).
Нужно помнить! Приставка ди- используется, если в молекуле кислой соли с одним кислотным остатком связаны два атома водорода, например: NaH2PO4 – дигидроортофосфат натрия, Ca(H2PO4)2 – дигидроортофосфат кальция.
 – O
– O

 2 иона H – O – P = O или –
2 иона H – O – P = O или – 
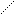 водорода Н – О
водорода Н – О
дигидроортофосфат – анион
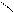 Н – О
Н – О
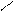 Н – О – Р = О –
Н – О – Р = О –
Н – О
ортофосфорная
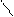 кислота 1 ион – О
кислота 1 ион – О

 водорода – О – Р = О или =
водорода – О – Р = О или = 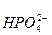 .
.
Н – О
гидроортофосфат – анион
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 1021; Нарушение авторских прав?; Мы поможем в написании вашей работы!