
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Дебиеттер тізімі 5 страница
|
|
|
|
DS=2*197.5-213.7-5.7=175.4Дж/моль*К.
Ретсіздік дәрежесін сипаттайтын энтропия берілген бағытта процестің өздігінен жүру мүмкіндігін анықтайтын екінші бір фактор болып табылады.
Процестердің бағыты. Изобаралық потенциал. Гиббс энергиясы.
Химиялық реакция барысында бір мезгілде екі тенденция (ұмтылыс) әсер етеді: Бөлшектердің күрделенуі, бірігуі, бұл энтальпияны азайтады (DН<0). Екінші ұмтылыс: бөлшектердің жекеленуге тырысуы, бұл – энтропияны арттырады (DS>0).
Осы екі қарама-қарсы ұмтылыстың жиыны (әсері) изобаралы-изотермиялық потенциалдың өзгеруін немесе Гиббс энергиясын көрсетеді:
DG=DH - TDS
DG0298=кДж/моль, ккал/моль.
Жай заттың ең тұрақты модификациясының түзілуінің DG0298 –мәні нөлге тең деп алынады. DН и DS есептегендей, Гиббс энергиясының өзгерісін DGх. р. =SDG.өнім-SDGбаст.зат. есептейді.
DG өзгеру сиапты мен процесті іске асырудың мүмкіндігі немесе мүмкін еместігі жөнінде бағалауға болады. Тұрақты температурада және қысымда реакция өздігінен жүреді де тек жүйенің Гиббс энергиясының азаю бағытында, яғни DG<0 (-), егер DG>0 (+) стандартты жағдайда реакция кері бағытта жүреді, ал DG=0 болғанда химиялық тепе-теңдік орнайды. DН=Т*DS. Осыдан температураны есептеуге болады.
Қалыпты температурада көпетеген реакциялар үшін ТDS-шамасы DН-қа қарағанда төмен, сол себептен DG-ң таңбасы мен мәніне энтальпиялық фактор әсер етеді, яғни экзотермиялық процесстер өздігінен жүреді, ал эндотермиялық процестер DН>0 ерекше жағдайда.
Жоғары температурада DG-таңбасына және мәніне Т*DS шамасы әсер етеді. Мысалы көмірдің Сграф+СО2=2СО(г) жану реакциясы эндотермиялық жүйенің көлемі ұлғаюмен жүреді, басталған реакция өздігінен көмір толық жанып біткенше жүреді.
Химиялық кинетика. Тепе-теңдік.
Химиялық термодинамика – химиялық реакциялардың жүру мүмкіндігін бағалауға мүмкіндік береді. Химиялық өзгерістердің жылдамдығымен механизмін химияның ерекше жеке бөлімі – химиялық кинетика зерттейді.
Кинетикалық теорияның міндеттері – химиялық реакция жылдамдығының әр түрлі факторларға: әрекеттесуші заттаардың табиғаты мен концентрациясына, температураға, катализаторға және еріткіштерге т.б. тәуелділігін табу. Химиялық процестердің заңдылығын білу оларды дұрыс басқаруға мүмкіндік береді, яғни қажетті комплексті қасиеті бар өнім алу, осындай өнім алудың жылдамдығын арттыру, сонымен қатар қажетсіз процестерді азайту. Реакциялар гамогенді және гетерогенді болады. Гомогенді реакциялар бір текті ортада жүреді; т.а. бүкіл көлемінде (мысалы, газдар арасында немесе ерітіндіде).
Гетерогенді реакциялар фазалар шегінде жүреді: қаттымен сұйық, газбен сұйық.
Реакция жылдамдығы уақыт бірлігінде белгілі бір көлемде (гомогенді реакциялар үшін) немесе беттік жанасу бірлігінде (гетерогенді реакциялар үшін) жүретін элементарлы бөлшектердің әрекеттесу санымен анықталынады. Реакция жылдамдығы әдетте әрекеттесуші заттардың консентрациясының уақыт аралығында өзгерісін сипаттайды. Ерітінділерде концентрация – моль/л, газдарда – парциальды қасыммен, уақыт секундпен беріледі.
Концентрация өзгерісі DС=С2-С1 – уақыт аралығы Dt=t2-t1 болса, жылдамдық
 мен анықталынады.
мен анықталынады.
+, - әрекеттесуші заттар концентрациясы кеміп, реакция өнімі орта болғандықтан қойылады. Реакция жылдамдығы туралы жүйенің белгілі –бір қасиетінің өзгеру жылдамдығы бойынша бағалауға болады, мысалы түсі, электрөткізгіштігі, спектр түрі, тұнба түсі, газ бөлінуі және т.б.
Гомогенді химиялық реакциялардың жылдамдығы. Концентарция әдісі. Әрекеттесуші массалар заңы.
Химиялық реакциялардың мәні – валенттік электрондардың өзара топтасуы жаңадан түзілген заттардың бөлшектерінде байланыс ретінің өзгеруіне әкеліп соғуында, бұл жағдайда атомдар құрамы өзгеріссіз қалады.
Процесс жылдамдығы бөлшектердің концентрациясымен анықталынатын, олардың соқтығысу түйісу ықтималдығына пропорционал.
Ықтималдылық теорисына сәйкес тәуелсіз істердің бір уақытта іске асу ықтималдығы олардың әрқайсысының ықтималдығының көбейтіндісіне тең. Бұл заңдылық 1865-67 жылдары К. Гульдберг және П. Вааге, И.И. Бекетов еңбектерінде көрсетілген, химиялық кинетиканың негізгі заңы «Әрекеттесуші массаларң заңы деп аталады.
Тұрақты температурада гомогенді химиялық реакция жылдамдығы стехиометриялық коэффициенттері дәрежесінде көрсетілген әрекеттесуші заттардың концентрациясының көбейтіндісіне тура пропорционал. Мысалы: реакциялар үшін:
І Н2+Cl2=2HCl, V=K*CH2*CCl2
ІІ 2NO+O2=2NO2, V=K*CNO*CO2
Бірінші жағдайда, «Әрекеттесуші массаларң заңына сәйкес реакциялар жылдамдығы хлормен сутектің концентрациясына бірдей дәрежеде болады. Екінші мысалда азот (ІІ) оксиді концентрациясына көбірек (C2NO) тәуелді болады.
К – жылдамдық константасы, берілген жағдайда заттардың жалпы концентрациясының қай бөлігі әрекеттесетін көрсетеді. Бұл константа заттың табиғатына және температураға тәуелді.
К-ның мәні сан жағынан әрекеттесуші заттар концентрациясы бірге тең болған жағдайда реакция жылдамдығына тең.
V=K
Егер бөлшектердің соқтығысуы ғана реакцияның жүруі үшін міндетті және жеткілікті жағдай болса, онда реагенттердің бірдей концентрациясында процесс жылдамдығының әр түрлілігін түсіндіре алмаймыз. 101,325 кПа қысымда және 5000С-та см3 газда соқтығысу саны 1028 болар еді. Осы соқтығысу өзара әрекеттесумен аяқталса, реакция өте тез қопарылыспен өтер еді. Яғни эффективті соқтығысу саны тек олардың жалпы санына пропорционал.
Химиялық реакциялар механизмі.
Жалпы теңдеумен көрсетілетін бромды сутектің 400-6000С –та тотығу реакциясын қарастырайық:
4НBr+O2=2H2O+2Br2
Кинетикалық теңдеуін жазамыз:
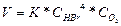
«Әрекеттесуші массаларң заңына сәйкес реакция жылдамдығы бромсутек концентрациясына өте байланысты, оттектің концентрациясына қарағанда, ал нақтысында екеуіне бірдей дәрежеде байланысты: V=K*CHBr*CO2.
Егер бұл реакция жалпы теңдеу бойынша іске асатын болса, бір мезгілде 5 бөлшек соқтығысу қажет, мұның ықтималдылығы аз. Тәжірибе жүзінде бұл процесстің тек қосарлы соқтығысу болатын бірнеше тізбекті сатыда жүретіні дәлелденген:
1 HBr+O2=HOOBr (баяу)
2 HBr+HOOBr=2HOBr (тез)
 3 2HBr+2HOBr=2H2O+2Br2 (тез)
3 2HBr+2HOBr=2H2O+2Br2 (тез)
Жалпы: 4HBr+O2=2H2O+2Br2
Реакциялар жүретін жәй сатылардың тізбекті қатарын осы реакциялардың механизмі дейміз. Жалпы процесстердің жылдамдығы механизмінің ең баяу сатысымен анықталынады да лимитрлеуші сатысы деп аталынады.
Стехиометриялық теңдеулер – барлық реагенттердің мөлшерінің өзгеруінің көрінісі, бұлар өтетін процестің механизмін толық көрсетпейді.
Кейбір аздаған процестер үшін, механизмдері стехиометриялық теңдеулерін сипаттайды. Бұларға:
 N2O4 2NO2
N2O4 2NO2
H2+І2 2HІ реакциялары жатады.
Хлорлы сутегін синтездеу процесі H2+Cl2=2HCl теңдеуі бойынша емес, тізбекті мезанизм бойынша жүреді.
Процестің іске асуына қатысатын бөлшектердің табиғатына байланысты химиялық реакциялар механизмі радикальді, ионды, молекулалық болып классификацияланады. Химиялық әрекеттесулердің элементарлық сатысына қатысатын молекула саны реакцияның молекулярлығын анықтайды.
 І 23892U®23490Th+42He мономолекулярлық
І 23892U®23490Th+42He мономолекулярлық
І2=2І
ІІ H2+І2=2HІ – бимолекулярлық
2NO+O2=2NO2 – үш молекулярлық.
Төрт молекулярлық реакциялар іс жүзінде белгісіз.
Химиялық реакция жылдамдығының температураға тәуелділігі.
Тәжірибе жүзінде табылған Вант-Гофф ережесімен сипатталынады: температураны әр 100С-ға арттырғанда реакция жылдамдығы 2-4 есе өседі.

g - реакция жылдамдығының температуралық коэффициенті. Мәні 2-4 аралығында болады. Мысалы, g=2 болғанда, температураны 1000С-ға арттырғанда, химиялық реакция жылдамдығы 1024 рет өседі. Себебі
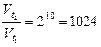
соқтығысу саны бұл жағдайда небәрі 1,2 рет өседі.
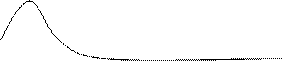
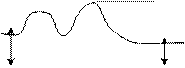
Эффективті мен жалпы соқтығысу арасындағы байланыс айғақталады, егер әр түрлі температурадағы Т3>Т2>Т1 молекулалардың энергиясы бойынша таралуын қарастырсақ:
|
|
|
|










            Энер. ие бөлшек саны Энер. ие бөлшек саны
|
Кинетикалық энергия
Графиктен көрініп тұрғандай, көптеген бөлшектер орташа жылдамдыққа ие, яғни орташа энергиялы бөлшектер.
Жоғары жылдамдықты немесе көп энергиялы молекулалар мөлшері Максвелл-Больцман заңы бойынша
 қатынасымен анықталынады.
қатынасымен анықталынады.
Мұндағы N – жалпы молекла саны;
NA – активті молекула саны, ол жалпы молекулалар санынан е-e/RTкөбейткішпен есептелінеді. Сол себептен, температураны әр 100С-ға арттырғанда, активті молекулалар саны 2-4 рет өседі.
Активтендіру энергиясы.
Соқтығысушы бөлшектер, олардың электрондық бұлттарының арасында пайда болатын тебіліс күштерін (энергетикалық барьер) жоюға жеткілікті энергиясы болса ғана, әрекеттесуі мүмкін. Осындай реакцияға түскіш бөлшектерді активтілер деп атайды да, энергетикалық барьерді (асуды) жоюға қажетті энергияны активтендіру энергиясы дейді.
|
|


|
|
 Реакциялардың координаталары
Реакциялардың координаталары
Әрекеттесу процесінде болатын (яғни байланыстардың өзара таралуында) активті бөлшектердің шоғырын активтелген комплекс дейді.
Химиялық өзгерістерде жүйенің SНбастапқы энергетикалық күйінен SНөнім күйіне ауысуы энергетикалық барьер арқылы өтеді Еа. Энергетикалық диаграммада нақты көрсетілгендей, бастапқы және соңғы энергия деңгейінің айырмасы жылу эффектісін береді, DН.
Н2+І2=2HІ+17кДж
Н2 и І2 активті молекулалары соқтығысқанда аралық активті комплекске бірігеді де
Н-Н және І-І, Н2…І2, байланыстары бір мезгілде үзіле, H-І байланыстары түзіле бастайды.


 H· ·H H·-------·H H· ·H
H· ·H H·-------·H H· ·H
® ® ®2HІ
 І· ·І І·-------------·І І· ·І
І· ·І І·-------------·І І· ·І
Активтелген комплекс
Нәтижесінде активтендіру энергиясы Еа=168кДж бастапқы молекуладағы байланысты толық үзуге қажетті энергиядан Еа=571кДж аз болады екен.
Әрекеттесуші заттарды активті комплекс күйіне өзгертуге, ауыстыруға қажетті энергияны активтендіру энергиясы дейміз. Температура артқан сайын активті молекулалар саны тез өседі, бұл реакция жылдамдығының күрт артуына әкеледі. Жылдамдық константасының активтендіру энергиясына тәуелділігі Аррениус теңдеуімен өрнектелінеді:
К=Z*P*e-Eа/RT
Z –соқтығысқан молекулалар саны әр секунд сайын;
е – натуральді логарифмнің негізі;
Р – бағытталған көбейтікш, молекуланың ыңғайлы орналасуын ескереді.
Аррениус теңдеуімен, активтендіру энергиясы төмен болған сайын, реакцияның жылдамдық константасы жоғары болатыны көрініп тұр.
Гетерогенді химиялық реакциялардың жылдамдығы.
Техникады маңызды көптеген химиялық процестер осы гетерогенді реакцияларға жатады: қатты және сұйық отындардың жануы, металдардың химиялық коррозиясы, металдарды құю және т.б. Гетерогенді реакциялар фазалардың беттік шегінде іске асады: беттік ауданы көп болса, соғұрлым әрекеттесуші заттардың заттардың молекуласының соқтығысу ықтималдылығы жоғары болады. Яғни жылдамдық газ немесе сұйық заттардың концентрациясына ғана емес, фазалар арасында жанасу бетінің ауданына да байланысты.
Көмірдің жану реакциясы үшін:
Ств+О2(г)=СО2(г) және V=K*CO2*SCтв.
Егер жанасу беті К*SCтв=К тұрақты болса, әсер етуші массалар заңы бойынша гетерогенді реакциялар үшін кинетикалық теңдеу өрнегі V=K*CO2.
Гетерогенді химиялық реакциялар жылдамдығы нақты реакция жылдамдығымен әрекеттесуші заттардың жанасу бетіне келу, реакция өнімдерінің диффузия арқылы одан үзілу жылдамдығының жиынан тұрады. Гетерогенді реакция жылдамдығының диффузияға қатысты математикалық тәуелділігі Нернст теңдеуімен өрнектеледі.
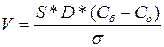
S-жанасу беті;
D-диффузия коэффициенті;
s-дифф. қабатының қалыңдығы.
Бөлшектің алымында жылдамдықты арттыратын факторлар, яғни V-арттыру үшін қатты затты ұсақтау керек және жақсы араластыру керек.
Катализ.
Катализ – химиялық практикада реакция жылдамдығын тездетудің кең тараған жолдарының бірі болып табылады. Катализатор мен әрекеттесуші заттардың агрегаттық күйіне байланысты гомогенді және гетерогенді катализ болып бөлінеді.
Катализатор дегеніміз – реакция компоненттерімен (құрауыштарымен) аралық химиялық әрекеттесуге қатысып, реакция жылдамдығын өзгертетін, бірақ әрекеттесуден кейін химиялық құрамын сақтап қалатын заттар. Катализаторлар тек термодинамикалық мүмкін реакцияларды ғана тездетеді DG<0 (-).
|
|


 Н
Н
 |
|
|
|
|
Реакция барысы
Активтендіру энергиясы жоғары болғандықтан өте төмен жылдамдықпен жүретін А+В=АВ реакциясын қарастырайық. Бірақ А заты К-мен оңай әрекеттеседі. Нәтижесінде АК қосылыс түзеді. Бұл процестің табиғаты басқаша. АК – қосылысы В – затымен әрекеттеседі:
А+К®А…К®АК+®…АК®АВ+К
Актив. Актив.
комплекс комплекс
Реакция нәтижесінде катализатор өзгеріске ұшырамайды. Гетерогенді катализге басты роль алатын – адсорбция. Беттік жанасудың бос энергиясы арқылы адсорбция әрекеттесуші заттардың концентрациясының өсуіне әсер етіп активтендіру энергиясын азайтады. Мысалы: сутектің асқын тотығының ыдырауы:
Н2О2®Н2О+0,5О2.
Активтендіру энергиясы катализ қатысынсыз Еа=75,7кДж/моль, катализ қатысында 49,0кДж/моль және І=56,5кДж/моль
Химиялық тепе-теңдік.
Кейбір химиялық реакциялар бір бағытта ғана жүреді, бастапқы заттар толығымен реакция өніміне ауысқанша. Мысалы:
2КClO3 ® 2KCl+3O2
 Көптеген реакциялар қайтымды. Бастапқы заттар концентрациясының азаюы, реакция өнімдерінің концентрациясының өсуіне әкеледі. Реакция өнімдері өзара әрекеттесіп бастапқы заттар түзіледі. Қайтымды реакцияларда (=) белгісі белгісімен ауыстырылады.
Көптеген реакциялар қайтымды. Бастапқы заттар концентрациясының азаюы, реакция өнімдерінің концентрациясының өсуіне әкеледі. Реакция өнімдері өзара әрекеттесіп бастапқы заттар түзіледі. Қайтымды реакцияларда (=) белгісі белгісімен ауыстырылады.
Екі газдың әрекеттесуі нәтижесінде СО и NO2 қоңыр газ азайып, тура және кері реакция жылдамдығы теңескенде тоқтайды, химиялық тепе-теңдік орнайды.
 NO2+CO NO+CO2
NO2+CO NO+CO2
® ®
Тура реакция жылдамдығы V1=K1*CNO2*CCO.
Кері реакция жылдамдығыV2=K2*CNO*CCO2.
Химиялық тепе-теңдік орнағанда
® ®
V1=V2, осыдан К1*CNO2*CCO=K2*CNO*CCO2.
®
К1 және К2 белгілі бір температурада тұрақты болса, олардың қатынасы да тұрақты болады.
 тепе-теңдігі
тепе-теңдігі
Кр – тепе-теңдік константасы динамикалық тепе-теңдік күйінде тұрған процестер «Әрекеттесуші массаларң заңына бағынады. Тепе-теңдік константасына кіретін концентрацияларды тепе-теңдіктегі концентрация дейміз.
Газ күйіндегі заттар үшін компоненттердің концентрациясының орнына оларға сәйкес нақты қысымның мәнін қолданған ыңғайлы. Мынадай реакция үшін:
аА+вВ mM+nN болады

Р – нақты қысымы..
Қатты және газды гетерогенді жүйедегі реакциялар үшін қатты фазаның қысымы өте аз болғандықтан негізінен реакцияға қатыспайды, себебі әрекеттесу тек жанасумен жүреді. Сондықтан тепе-теңдік константасын газ күйіндегі заттың қысымы арқылы өрнектеуге болады. Мысалы:
С(тв)+СО2(г)=2СО(г)

Тепе-теңдік константасы химиялық реакцияның басты сипаттамасы болып табылады. Кр мәні көп болса, реакция соғұрлым толық жүреді, яғни өнімі жоғары болады. Қайтымсыз реакциялар үшін Кр® шексіздікке ұмтылады. Егер К®0 болса, онда ешқандай әрекеттесу болмайды. Гиббс энергиясы тепе-теңдік константасымен мынадай қатынаста байланысты
DG= -RT*lnKp
Химиялық тепе-теңдіктің ығысуы. Ле-Шателье принципі.
Химиялық тепе-теңдік жағдайы көптеген факторларға байланысты: температураға, қысымға, концентрацияға және т.б. Осы факторлардың біреуін өзгерткенде химиялық тепе-теңдік ығысады. Тепе-теңдікте тұрған жүйеде барлық қоспаның концентрациясын өзгертпей-ақ осы заттардың біреуінің ғана концентрациясын өзгертуге болмайды.
Тепе-теңдік жүйе берілген жағдайда реакция өздігінен жүретін шегін көрсетеді.
DG<0, яғни энергия шығынсыз. Бұл тепе-теңдік жағдай Ле-Шателье принципімен түсіндіріледі.
 Тепе-теңдік күйдегі жүйеге сырттай әсер еткенде, жүйеде осы әсерді азайтатын процесс күшейеді.
Тепе-теңдік күйдегі жүйеге сырттай әсер еткенде, жүйеде осы әсерді азайтатын процесс күшейеді.
 3H2+N2 2NH3+46.2кДж
3H2+N2 2NH3+46.2кДж
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 1244; Нарушение авторских прав?; Мы поможем в написании вашей работы!