
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Дебиеттер тізімі 4 страница
|
|
|
|

 CH4, CF4, GeCl4
CH4, CF4, GeCl4
sp3, 1090
s+p+p+p тетраэдриялық
Байланыс полюсті болса да, sp-, sp2- және sp3-гибридтелуге тән барлық қарастырылған молекулалар полюссіз, себебі молекуладағы теріс және оң зарядтардың геометриялық ортасы беттеседі (үйлеседі). Гибридтелудің басқа түрлері де болуы мүмкін, мысалы бір s-, және үш p- жәна d-орбиталдар гибридтелуінен үш бұрышты бипирамида түзіледі.
Күрделі иондардың беріктігі, sp3-гибридтелу күйі азайған сайын кемиді:
SіO44-тен®PO4-3®SO4-2®ClO4-1-ке кемиді.
Орталық атомның радиуысының артуы, sp3-гибридттік күйде азайтады, молекуланың беріктігі төмендейді, байланыс бұрышы 900-қа жақындайды және мұндай молекулаларға байланыс таза, гибридтті емес.
NH3®PH3®AsH3®SbH3
1070 940 920 910
H2O®H2S®H2Se®H2Te
1050 920 910 900
PF3®PBr3®PІ3®PCl3
104 100 98 92
sp3-гибридтік азаяды.
Байланыс полюстігі.
s-байланыс түзетін орбиталдардың қабаттасуы бір элемент атомдарының ядросынан бірдей қашықтықта іске асырылса, мұндай байланысты ковалентті полюссіз дейміз, бір атомға қарай ығысу болмайды (H2, F2, Cl2, Br2, І2).
HІ, HCl, HBr, HF – молекулалар түзілгенде байланыс ковалентті полюсті болады.
Атомдардың өзіне электрон жұптарын табу қабілетін электртерістілік деген шамамен сипаттайды (ЭТ). Бұл шама электронға ынтықтықпен (Е), иондану энергиясын (І) қосыныдысының жартысына тең болады.

Электронға ынтықтық энергиясы – бейтарап атомға электрон қосылғанда бөлінетін энергия. Бұл энергия топ нөмірі артқан сайын өседі, яғни период бойынша солдан оңға, топ бойынша төменнен жоғары. Электронға ынтықтық элементтердің бейметалдық қасиетін сипаттайды. Шамасы көп болса, бейметалдың активтігі жоғары.
Иондану энергиясы – атомнан электронды үзіп алу үшін жұмсалаитын энергия. Бұл металдық қасиетін сипаттайды, шамасы төмен болса, метал активті. Электротерістігі жоғары элемент – фтор, ең төмені – франций.
Элементтердің салыстырмалы терістігі:
| І | ІІ | ІІІ | ІV | V | VІ | VІІ |
| H | ||||||
| 2.1 | ||||||
| Lі | Be | B | C | N | O | F |
| 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| Na | Mg | Al | Sі | P | S | Cl |
| 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 |
 Егер СЭТ айырмасы >1,7-байланыс иондық, егер <1,7 болса – ковалентті полюсті. Полюсті байланысты екі атомды молекулалар дипольді болады. Дипольдік сәт m=q*l Дебаймен өлшенеді, мұнда q-заряд шамасы, l-ұзындығы.
Егер СЭТ айырмасы >1,7-байланыс иондық, егер <1,7 болса – ковалентті полюсті. Полюсті байланысты екі атомды молекулалар дипольді болады. Дипольдік сәт m=q*l Дебаймен өлшенеді, мұнда q-заряд шамасы, l-ұзындығы.
Мына қатарда байланыстың полюстігі кемиді: + ·¾· -
| H-F | H-Cl | H-Br | H-І |
| m=1,9Д | 1,3Д | 0,78Д | 0,38Д |
Молекулалық орбиталдар әдісі.
ВБ әдісінің көмегімен көптеген молекулалардың және молекулалық иондардың (Не2+, Н2+, Со-, No+) құрылысын түсіндіру мүмкін емес. Молекулалық орбиталдар әдісі атомдық орбитальдардың сызықтық комбинациясы болып табылады. Молекулалық орбитальдардың электрондармен толтырылуы Паули, ең аз энергия принципімен Гунда ережесіне сәйкес іске асырылады. Бір молекулалық орбитальда қарама-қарсы спинді екі электрон ғана орналаса алады. Ең алдымен, электрондарының энергиясы аз молекулалық орбитальдар толтырылады.
Молекуладағы молекулалық орбитальдар саны атомдардың атомдық орбитальдарының жиынына тең болады. Молекула түзілгенде екі атомдық екі орбитальдан екі молекулалық орбиталь алынады, бұлардың біреуі – байланыстырушы, ал екіншісі – босаңдатушы орбиталь.
Байланыстырушы орбитальдағы электрондардың энергиясы босаңдатушыға қарағанда төмен, сол сбептен ең алдымен байланыстырушы МО толтырылады.
МО әдісі бойынша байланыс реті (еселігі) байланыстырушы және босаңдатушы молекулалық орбитальдардағы электрондар санының айырмасының жартысына тең. Егер байланыс еселілігі нольге тең болса – молекула түзілмейді, егер бүтін сан немесе бөлшек сан болса – молекула түзіледі.
Молекуланың магниттік қасиеті тақ электрондардың (парамагнитті) болуымен немесе болмауымен анықталынады.
Молекуланың және молекулалық ионның Не2+ и Со- түзілуін қарастырайық:
| AO | MO | AO |
 1) H0 H2 H0
1) H0 H2 H0

 босаң1s s
босаң1s s


 1s ¯
1s ¯
¯ s-байланыс1s2
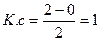
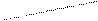
 Н2 - диамагниттік
Н2 - диамагниттік

 2) He0 s босаң 1s1 He+
2) He0 s босаң 1s1 He+


 1s2 ¯ 1s1
1s2 ¯ 1s1
¯ s-байланыс1s2
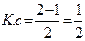
Н2 – парамагниттік
3)N2, 7N – 1s22s22p3 – екі азот атомының ішкі (1s2) төрт электроны химиялық байланысқа іс жүзінде әсер етпейді, себебі олар екі байланыстырушы және екі босаң орбитальдарға орналасқан, энергия ұтымы болмайды. Үш р-электрон 2р3 -, бір s-, екі p-байланыс түзеді.

 p босаң 2ру p босаң 2рz
p босаң 2ру p босаң 2рz

s босаң 2р


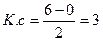 , N2 - диамагниттік
, N2 - диамагниттік
N0 2p3 ¯ ¯ ¯

¯ s-байланыс2р

p-байланыс 2ру ¯ ¯ p-байланыс 2рz

 Молекулалық ионда СO- оттегі электрон қосып алады.
Молекулалық ионда СO- оттегі электрон қосып алады.
p босаң 2ру p босаң 2рz



 p босаң 2р
p босаң 2р 

 С0 2р2 ¯ ¯ O-1 CO- - парамагниттік
С0 2р2 ¯ ¯ O-1 CO- - парамагниттік
 ¯ s-байланыс 2р
¯ s-байланыс 2р


p-байланыс 2ру ¯ ¯ p-байланыс 2рz
Химиялық байланыстың басқа түрлері.
1. Координациялық немесе донорлы-акцепторлық байланыс жұпталған электрондар мен бос орбитальдың әрекеттесуінен пайда болады. Жұпталған электрон беретін А компонент донор, ал В – бос орбиталь акцептор деп аталады.

 А: + В® А: В
А: + В® А: В
Донор акцептор
 N: + Н+ ® NH4+.
N: + Н+ ® NH4+.
2. Металдық байланыс металл кристалдарында және олардың құймаларында іске асырылады. Металдық кристалдық торлардың түйіндерінде металдардың иондары орналасады да, олардың арасында валенттік электрондар “шоғыры” қозғалып жүреді. Металдардың жалпы қасиеттері жылу- және электр өткізгіштігі, металдық жылтыры, жоғары қайнау-қату температурасы осымен түсіндіріледі.
Me+n Me0 Me+n


 · ·
· ·
Me0 Me+n Me0


 · ·
· ·
Металдық байланыс, коваленттік байланысқа қарағанда 3-4 есе осалдау (берік емес), делокализация салдарынан.
3. Сутектік байланыс сутегімен электротерістігі жоғары элемент әрекеттескенде түзіледі, бұл байланыс фтор, оттегі, аз мөлшерде азот, күкірт және хлор қосылыстарына тән. Сутектік байланысты схема түрінде үш нүктемен бейнелейді. Мысалы,
Н-О…Н-О…
 |  |
Н Н
Н-F…H-F…H-F
Сутектік байланыс каваленттік байланысқа қарағанда әлсіз, дегенмен димерлеу, полимерлеу жүруге жеткілікті.
Мына қатарда Н2О®Н2S®H2Se®H2Te
Tқайнау, К 373 213 232 271
HF® HCl ®HBr ® HІ
253 189
Судың және фторлы сутектің аномальді жоғары қайнау температурасы болуы осы заттардың молекулалары арасында сутектік байланыстың болуымен түсіндіріледі.
Молекула аралық байланыстар – молекулалар арасындағы Ван-дер-ваальстік әрекеттесуден түзіледі, мұндай байланыс балқу, кристалдану т.б. процестерде байқалады. Полюссіз молекулалар арасындағы әрекеттесу бір сәттілік дипольдер-дисперсиялық күштер есебінен пайда болады.
Полюсті молекуламен полюссіз молекуланың әрекеттесуін индукциялық әрекеттесу деп атайды. Ван-дер-ваальстік әрекеттесу энергиясы әдетте 4кДж/моль-ден аспайды.
Негізгі әдебиет:[1] – 109-164б; [2] – 109-149б; [3] – 35-71б; [4] – 56-100б; [5] –95-104б; 112-121б; [5] – 76-114 б;
Қосымша әдебиет: [8] – 48-57б.
Бақылау сұрақтары:
1. Химиялық байланыстың түзілуіне не себеп?
2. Химиялық байланыстың табиғаты қандай?
3. Коваленттік байланысқа анықтама беріңіз. Олардың күйлерін айтыңыз.
4. Коваленттік байланыстың түзілуінің екі механизмі қандай?
5. Атомдардың орбиталының гибридтелуі деп нені айтамыз? Оның қандай түрлері бар?
6. Иондық байланысқа анықтама беріңіз. Оның қандай күйлері бар?
7. Молекулярлық орбиталдар әдіснің негізгі түсініктері нені білдіреді?
8. МО-ЛКАО әдісі бойынша байланыстыратын және байланыстырмайтын молекулярлы орбиталдар қалай түзіледі?
9. МО-ЛКАО әдісі бөлшектердің магниттік күйін, байланыстың реттілігін қалай түсіндіреді?
10. Қандай химиялық байланыс сутектік деп аталады? Ол қандай молекулалар арасында түзіледі?
V. Дәріс тақырыбы: Химиялық процестердің ағуының негізгі заңдылықтары (2 сағ.).
Дәріс конспектілері:
Химияның негізгі мәселесі химиялық реакциялар жөнінде болып табылады:
1) химиялық өзгерістердің жылдамдығы мен механизмін химиялық кинетика зерттейді;
2) химиялық өзгерістердің өздігінен жүру мүмкіндігі мен дәрежесін химиялық термодинамика зерттейді.
Химиялық қосылыстардың реакцияға түсу қабілеті мен химиялық реакция бағытын термодинамикалық немесе энергетикалық сипаттамаларын қарастыру, зерттеу арқылы болжауға болады. Физика-химиялық процестер әртүрлі (жылу-, жарық-, электрлік- немесе механикалық т.б.) формада энергия бөліне (экзо-) немесе сіңіріле жүреді.
1кал=4,187Дж=4,187*107эрг=0,427кгм.
Бұл мәліметтер әртүрлі реакциялардың энергетикалық эффектісін сандық жағынан салыстыруға мүмкіндік береді. «Химиялық реакцияның жылу эффектісің деп реакция өнімінің температурасы бастапқы заттың температурасындай болуы үшін өнімнен бөлінетін немесе өнімге берілетін жылу мөлшері болып табылады. Жылу эффектілерін термохимия зерттейді.
Ішкі энергия.
Химиялық реакция нәтижесінде энергияның бөлінуі немесе сіңірілуі барлық зат бойында көрінбейтін- жасырын энергия қоры бар екенін көрсетеді. Ішкі энергияның белгіленуі – U. Мәні жағынан барлық бөлшектер қозғалысының кинетикалық энергиясымен өзара әрекеттесуінің потенциалдық энергиясына тең.
U=Eк+Еп
Ішкі энергияның абсолютті мәнін өлшей алмаймыз, тек оның өзгерісін анықтаймыз:
DU=Uсоңғы-Uбастапқы
Ішкі энергия жиыны реакция өнімінің энергиясынан бастапқы зат энергиясын алғанға тең.
Ішкі энергия шамасы:
1) заттың табиғатына және агрегаттық күйіне байланысты, мысалы сұйық және газ күйінде азоттың молярлық энергиясы әр түрлі;
2) заттың мөлшеріне Н2, 1моль немесе 2 молі;
3) температураға – қыздыру молекулалардың жылулық қозғалысын, яғни Ек ортады;
4) қысым (Р) бөлшектердің ара-қашықтығына, яғни электрон мен ядро әрекеттесуіне немесе Еп өзгертеді.
Жылу эффектісі және әрекеттесуші заттардың агрегаттық күйі көрсетілген химиялық реакция теңдеулерін термохимиялық теңдеулер деп атайды.
СН4(г)+2О2(г)=СО2(г)+2Н2О(ж)+802кДж
Термодинамиканың І-ші бастамасы.
Жүйе дегеніміз – зерттеу үшін ойша немесе әдейі қоршаған ортадан жекеленетін заттар немесе заттар жиыны. Энергия мүмкін болатын екі формада беріле алады: жылу (Q) және жұмыс (А) арқылы.
Кез-келген процесте жүйе сіңіретін жылу оның ішкі энергиясының өзгеруіне (DU) және сыртқы күшке қарсы істелетін жұмысқа (А) кетеді:
Q=DU+А
Бұл термодинамиканың І-заңының математикалық өрнегі. Жылу эффектісі реакцияны жүргізу жағдайына байланысты: тұрақты көлемде – изохоралық, тұрақты қысымда – изобаралық режим болады.
Изохоралық-изотермиялық реакциялар арнайы калориметрде жүргізіледі, көлемі өзгермейді, жұмыста істелінбейді. А=0,
Q= DU
Яғни тұрақты көлемде жылу эффектісі ішкі энергияның өзгеруімен ғана анықталынады:
QV,T=DU.
Изохоралық-изотермиялық жылу эффектісі. Энтальпия.
Көптеген химиялық реакциялар ашық колбада жүреді. Мысалы:
Zn+2HCl=ZnCl2+H2
Түзілген сутегі қысымды тұрақты шамада сақтай отырып, көлемді өзгертіп сыртқы күшке қарсы жұмыс жасайды.
А=Р*DV, осыдан
QP,T=DU+РDV
мұндағы DU=U2-U1
DV=V2-V1
QP,T=U2-U1+P(V2-V1)

 QP,T=(U2+PV2) - (U1+PV1)
QP,T=(U2+PV2) - (U1+PV1)
H2 H1
U+PV мәнін Н – энтальпия арқылы белгілеп
QP,T=H2-H1=DH – энтальпия өзгерісі.
DH – энтальпия кеңейген жүйенің энергиясын көрсетеді. Егер реакция экзотермиялық болса, жүйенің энергиясы кемиді: QP,T= -DH. Мысалы, сұйық және газ күйіндегі судың түзілу диаграммасының энтальпиясын қарастырайық.
Әртүрлі реакциялардың жылу эффектісін салыстыру үшін стандартты жағдайда өлшейді: 298К немесе 250С және де қысымы 101,3кПа немесе1атм. Осы жағдайдағы мәнін стандартты жылу эффектісі деп DН0298 белгілейді, өлшем бірлігі кДж, ккал.
Г.И. Гесс заңы.
Іс жүзінде жылу эффектілерін калориметрмен анықтайды, ал тәжірибемен анықтау мүмкін болмаған жағдайда термохимияның заңдарына негізделген термохимиялық есептеулер қолданылады. Бұл заңның бірін энергияның сақталу заңының көрінісі ретінде Петербург химигі Г.И.Гесс 1840 жылы тұжырымдаған: реакцияның жылу эффектісі оның жүрген жолына тәуелді емес, тек қана алынған зат пен реакция өнімінің табиғатымен және күйімен анықталынады.
1 моль сутегімен 0,5 моль оттегінің әрекеттесуінің нәтижесінде және су буының конденсациясынан түзілген сұйық судың энтальпиялылық диаграммасы Гесс заңын растайтын мысалдардың біреуі.
Күрделі заттың түзілу энтальпиясын – 1 моль деп белгілейміз. Осы заттың бұларға сәйкес келетін жай заттардың тұрақты күйінен түзілген реакцияның жылу эффектісі деп атайды. Стандартты түзілу энтальпиясы DН0f,298 деп белгіленеді, өлшем бірлігі ккал/моль, кДж/моль (f – faundeshіn-“түзілу” деген мағынада).
Жай заттардың түзілу энтальпиясы нольге тең. Мысалы: H2, O2, C, S, Cu, Zn және т.б.
Түзілу энтальпиясы:
1) химиялық қосылыстардың беріктігін сипаттайды;
2) реакцияға қатысушы заттардың түзілу энтальпиясын біле отырып, жылу эффектісін анықтауға болады;
3) Лавуазье-Лаплас заңына сәйкес химиялық қосылыстың ыдырау энтальпиясы мәні жағынан түзілу энтальпиясымен тең, ал таңбасы қарама-қарсы болады:
DН0298, обр= -DН0298, ыдырау.
| Al2O3 | SіO2 | SіH4 | |
| DН0f,298 кДж/моль | -1676 | -905 | 34,7 |
Алюминий, кремний оксидтері берік заттар, ал SіH4 – тұрақсыз, өздігінен қопарылады, яғни реакцияға түскіш.
Химиялық реакцияның жылу эффектісі – реакция өнімдерінің түзілу энтальпиясының жиынынан бастапқы заттардың түзілу энтальпиясының жиының стехиометриялық коэффициенттерді ескере отырып алғанға тең.
Анықтама оқулықтарда күрделі заттардың стандартты түзілу энтальпиясы беріледі.
DН0298, х. р.=S DН0f,298 өнім. -SDН0f,298 баст.
І Cr2O3(к)+2Al(к) = Al2O3(к)+2Cr(к).
ІІ Cr2O3(к)+3Н2(г) = 3Н2О(г)+2Сr(к).
| -1440,6 | -1676,0 | |||
| DН0f,298 кДж/моль | -1440,6 | -241,8 |
DН0298, І = -1676-(-1440.6) = -236кДж
DН0298, ІІ = -(3*241.8) – (-1440.6) = 715кДж
І-реакция бірталай жылу эффектісімен сипатталады, жүруі мүмкін.
ІІ-реакция стандартты жағдай жүрмейді.
Тәжірибе жүзінде, (өз бетімен) өздігінен экзотермиялық реакциялар жүретіндігі көрсетілген.
Na+0.5F2=NaF+574кДж
Na+0.5Cl2=NaCl+412кДж
Na+0.5І2=NaІ+289кДж
Бертло-Томсон принципіне сәйкес: Энергия көп бөлінген сайын, реакция толығымен жүреді, өнім соғұрлым берік болады. Яғни натридтің фторға ынтықтығы жоғары.
Энтропия.
Химиялық реакциялардың өздігінен жүруін ылғи да минимальді энергияға балалап түсіндіруге болады. Мысалы, ретсіздікке ұмтылу, диффузия, шашырау, жоғары температурада эндотермиялық реакциялар, заттың еруі және т.б. өздігінен жүреді. Өзара әрекеттеспейтін екі газдың араласуы энергия қажетінсіз, ретсіздік өсу жағына өздігінен жүреді. Осы бағытта жүруінің ықтималдығы жоғары. Ретсіздік дәрежесін сандық жағынан сипаттау үшін энтропия деген түсінік кіргізілген, белгісі - S, өлшем бірлігі S0298 = Дж/моль*К.
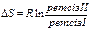
Энтропия:
1) заттың табиғатына;
2) агрегаттық күйіне
3) P,V,T – яғни реакцияны жүргізу жағдайына байланысты болады.
Жүйеде ретсіздікті көбейтуге себепші факторлар энтропияның өсуіне әкеліп соғады (DS>0).
Мысалы, кристалдық заттардың еруі, сұйықтың буға ауысуы т.б. Керісінше заттардың конденсациясы, кристаллизациясы процесінде энтропия төмендейді (DS<0). Химиялық реакцияларда энтропия өзгеруін әрекеттесуші заттардың көлемі өзгеруімен бағалайды:
С(графит) +СО2(г)=2СО(г)
Бұл реакцияда көлем артады (DV>0), яғни энтропия өседі DS>0 (+).
Аммиактың түзілу жағдайында:
3Н2(г)+N2(г)=2NH3(г)
керісінше жүйенің көлемі кемиді DV<0 осыдан DS<0 (-). Кристалдық заттар арасындағы реакцияда
2Mg(к) + Sn(к) =Mg2Sn(к)
көлем өзгерісі байқалмайды
DV=0, DS=0.
Энтропияның өзгеруі Гесс заңына бағынады:
DS=SSпрод -SSисх.в-в.
Термодинамика заңы бойынша: жай заттың түзілу энтальпиясынан өзгешілігі жай затттың энтропиясы нольге тең болмайды. Тек абсолютті нольге ғана кристалдағы бөлшектердің қозғалысы тоқталуы мүмкін.
Сграфит +СО2(г)=2СО(г)
S0298 = Дж/моль*К. 5,7 213,7 197,5
Энтропия мәні өседі, себебі көлем артады, газ тәрізді зат түзілген.
DS=2 S0298(CO) –(S0298 графит + S0298(СО2))
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 1801; Нарушение авторских прав?; Мы поможем в написании вашей работы!