
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Дебиеттер тізімі 3 страница
|
|
|
|
s- және p электрондарының жұпсыздануын қарастырайық:
| Қалыпты күйі | Вн | Қозған күйі | Вв | Мысалы | ||||||||
| 3Lі 1s22s1 | Вн=1 | 1s22s1 | Вв=1 | LіF, LіOH | ||||||||
| ¯ | ¯ | |||||||||||
| 4Be 1s22s2 | Вн=0 | 1s22s12p1 | Вв=2 | BeCl2, BeO, | ||||||||
| Be(OH)2, BeF2 | ||||||||||||
| | ||||||||||||
| ¯ | | |||||||||||
| 5B 2s22p1 | Вн=1 | 2s12p2 | Вв=3 | BF3, BH3 | ||||||||
| | | | ||||||||||
| ¯ | | |||||||||||
| 6C 2s22p2 | Вн=2 | 2s12p3 | Вв=4 | CO2, CH4, CCl4, | ||||||||
| CF4 | ||||||||||||
| | | | | | ||||||||
| ¯ | | |||||||||||
| 7N 2s22p3 | Вн=3 | 2s22p3 | Вв=3 | NH3, N2O3 | ||||||||
| | | | | | | |||||||
| ¯ | ¯ | |||||||||||
Азот атомында және екінші периодтың келесі барлық элементтерінде валенттік қозған күйі болмайды.
Азот тақ электрондар есебі бойынша үш валентті, оттегі – екі валентті, ал фтор – бір валентті болады.
Фосфорда азоттан өзгеше, бос 3d-орбиталь бар, сондықтан бес тақ электронды конфигурация түзілуі мүмкін.
15P 3s23p3
| | | | | |||||||||||||||||||||
| ¯ | | | | |||||||||||||||||||||
| | ||||||||||||||||||||||||
| Вн=3 (3р3) | Вв=5 (3s13p33d1) | |||||||||||||||||||||||
Атомдар өздерін тән тотығу дәрежесінде, инертті газдарға жақын тұрақты электрондық конфигурацияға ие болады.
Байланыстың еселілігі.
Химиялық байланысты түзуге бірс электрон жұбы қатысса байланыс еселілігі бірге, екі немесе үш электрон жұбы қатысса, осыған сәйкес байланыс еселігі екіге немесе үш кезеңге, яғни қос химиялық байланыс болады.
Сутегі молекуласының электрондық құрылысын және еселік байланысты кейбір молекулаларды қарастырайық:
1) Сутегі молекуласы.
1Н- 1s1 электронды және электронды графикалық формула
а) Н×+×Н® Н:Н®Н2


 в) Н + ¯ Н ® ¯
в) Н + ¯ Н ® ¯

 Н2
Н2





 S s
S s


 с) + ® x
с) + ® x
H2
х осі бойымен электрондық бұлттардың қабаттасуынан түзілген байланысты s - байланыс дейміз.
2) Оттгі молекуласы
8O – 2s22p4
| ¯ | | | |
| ¯ | z | у | х |
........
а):О:+:О: ®:О::О: ®О=О ®О2











 в) ¯ + ¯ ¯ ¯ ® ¯
в) ¯ + ¯ ¯ ¯ ® ¯


 ¯ ¯ ¯
¯ ¯ ¯




 p p-байланыс
p p-байланыс





 s
s

















 с) x + ® х х О=О
с) x + ® х х О=О
 p
p
у у у
х-осінің жоғарғы және төменгі жағындағы р-электронды бұлттардың қабаттасуынан түзілген байланысты p-байланыс дейміз. Оттегі молекуласында бір s- және бір p-байланыс.
3) Азот молекуласы.
7N – 2s22p3
| | | | |
| ¯ | X | у | z |
....
:N: +:N: ®:N::N: ® NºN®N2
в)
2s2 2p3 2p3 2s2
| ¯ | | | | + | ¯ | ¯ | ¯ | ¯ | ® | | | | ® | N | º | N | ® | N2 | ||
| ¯ | ¯ | ¯ |






















 p
p






 с) x + x ® x N s N ® N2
с) x + x ® x N s N ® N2
 p
p
у z у z у z у z
Азот молекуласында үш тақ электрон өзара перпендикуляр орбиталдарда орналасып бір s- және екі p-байланыс түзеді. Байланыс еселілігі көп болған сайын, берігірек байланыс ұзындығы, яғни атом ядросының аралығы қысқа (аз-) болады.
| Қосылыс | Байланыс | Энергиясы, КДж/моль | ұзындығы, нм |
| Этан | С-С | 0,1543 | |
| Этилен | С=С | 0,1353 | |
| Ацетилен | СºС | 0,1208 |
Көп атомды молекулалардың электрондық құрылысы.
Химиялық байланыстың бағытталуы.
1) АА немесе АВ типті молекулалар: F2, Cl2, Br2, І2, At2, HF, HCl, HBr, HІ, HAt.
F2 молекуласын қарастырайық
9F – 2s22p5
| ¯ | ¯ | | |
| ¯ |







 P p s
P p s


 + ® x F2
+ ® x F2
F F F-F
Молекула формасы F2 – сызықтық (байланыс бұрышы 1800) бір s-байланыс, ковалентті полюссіз.
НF молекуласы s элемент сутегімен, р – элемент фтормен түзілген.





 s p s
s p s


 H x + F x ® H-F ®HF
H x + F x ® H-F ®HF
НF – молекуласының формасы – сызықтық, бір s-байланыс, ковалентті полясті.
Молекулы типа А2В; Н2О, Н2S, H2Se, H2Te.

 Н2О молекуласы – s-элемент сутегінің екі аомынан және р-элемент оттегі атомынан түзілген.
Н2О молекуласы – s-элемент сутегінің екі аомынан және р-элемент оттегі атомынан түзілген.
s

 8О – 2s22p4 1H-1s1
8О – 2s22p4 1H-1s1
| ¯ | | | |
      ¯ ¯
|


 H O s
H O s








 + s ® H ® O ®H2O
+ s ® H ® O ®H2O





 s H H
s H H
H H 1050
Су молекуласының формасы- бұрыштық, аттас зарядталған сутегі атомдарының тебілуі есебінен валенттік бұрыштардың ұлғайуы байқалады, екі s-байланыс, ковалентті полюсті.
1) А3В типті молекулалар: NH3, PH3, AsH3, SbH3,BіH3.
NH3 молекуласы үш сутегі атомынан және кеңістіктегі координатаның х,у,z – осімен бағытталған үш р-электроны бар азот атомынан түзілген:
7N – 2s22p5
| | | | |
    ¯ ¯
|


 s
s









 s
s





 + s ® H ® NH3
+ s ® H ® NH3




 s s
s s
 s H H
s H H
Аммиак молекуласы үш бұрышты пирамида болып келеді, үш s-байланыс болады, байланыс бұрышы 107,30, ковалентті полюсті.
Су және аммиак молекуласындағы байланыс бұрышының 900-тан өзгеше болуы, олардың тетраэдриялық құрылысын көрсетеді, яғни тетраэдридің бір төбесінде бөлінбеген жұп электрон орналасқан.
Орбиталдардың гибридтелінуі.
Бір атомның өзінен химиялық байланыс түзуге бір мезгілде s-, және p-орбиталдар қатысуы мүмкін, бұл жағдайда олар теңесіп-араласып, гибридті электронды бұлттар түзеді. Гибридтелу түрлері: s-байланыс түзуге қатысатын орталық атомның sp-, sp2- және sp3-орбиталдары молекуланың геометриясын анықтайды. Төменде жиі кездесетін орбиталдардың гибридтелу түрлері және оларға сәйкес молекулалардың геометриялық формасына мысалдар берілген.
| Орталық атомның орбиталі, s-байланыс түзуге қатысатын | Гибридтелу түрі. Формасы. Байланыс арасындағы бұрыш | Молекулаларға мысалдар |





 МgCl2, CaF2, BeH2,
МgCl2, CaF2, BeH2,

 x sp,1800 BeІ2, BaCl2, BaH2,
x sp,1800 BeІ2, BaCl2, BaH2,
s+p сызықтық SrF2, SrІ2
 AlCl3, AlH3, BH3,
AlCl3, AlH3, BH3,





 x BF3, GaІ2, GaCl3
x BF3, GaІ2, GaCl3

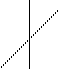
у
s+p+p sp2, 1200

 үш бұрышты
үш бұрышты

 |











 SіCl4, SіH4, CCl4,
SіCl4, SіH4, CCl4,
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 1033; Нарушение авторских прав?; Мы поможем в написании вашей работы!