
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Дебиеттер тізімі 2 страница
|
|
|
|
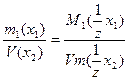

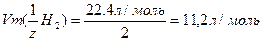
9. Заттың газ күйінің заңдары.
Газ көлемі газдың табиғатына, массасына және ортаның жағдайына – температура мен қысымға байланысты.
Гей-Люссак заңы бойынша: қысым тұрақты болғанда (Р=const) газдың берілген массасының көлемі абсолюттік температураға тура пропорционал болады.

Бойль-Мариотт заңы бойынша: тұрақты температурада (Т=const) берілген газ массасының көлемі олардың қысымына кері пропорционал болады:
P1V1=P2V2=PnVn=const
Осы екі заңды біріктіре отырып және қалыпты жағдайдағы газдардың күйін P0, V0, T0 деп белгілеп Клапейрон теңдеуін аламыз:
 |
Бұл теңдеу көмегімен кез-келген газ көлемін қалыпты жағдайға келтіруге (қ.ж.) болады:
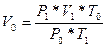
Қалыпты жағдайда:
Р0=101,325 кПа, немесе 1 атм. немесе 760 мм сн. бағ.
Т0=273 К, немесе 00С, V0=22.4 л.
Тұрақты шамалар қатынасы да тұрақты R-шама.
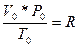
Газ тұрақтысы деп аталады, берілген жағдайға байланысты өлшем бірлігі әр түрлі болады:
R1=8.314Дж/моль*К,
R2=1.987кал/моль*град,
R3=0.082л*атм/моль*град.
І-теңдеу n-моль газ мөлшері үшін:

P1V1= n*RT немесе  (ІІ) Клапейрон-Менделеев теңдеуі деп аталады. Бұл теңдеу көмегімен белгісіз заттың (m) массасын, М – молярлық массасын, жүйедегі Р - қысымды, V - көлемімен Т - температураны есептеуге болады.
(ІІ) Клапейрон-Менделеев теңдеуі деп аталады. Бұл теңдеу көмегімен белгісіз заттың (m) массасын, М – молярлық массасын, жүйедегі Р - қысымды, V - көлемімен Т - температураны есептеуге болады.
Авогадро заңы. Мольдік көлем. Газдардың салыстырмалы тығыздығы.
1811 жылы Авагадро ашқан заң анықтамасы: кез-келген газдың бірдей көлемінде бірдей жағдайда молекулалар саны тең (бірдей) болады.
Кез-келген газ немесе бу күйіндегі заттың 1 моль қалыпты жағдайда 22,4 л көлем алады. Бұл көлемді – молярлық көлем деп, Vm – деп белгілейді, өлшемі – л/моль, см3/моль:
Vm=22,4 л/моль
Бірдей көлемдегі, бірдей молекула саны болатын кез-келген газдардың массасының қатынасы, олардың молярлық массасының қатынасындай болады:
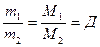
Д – газдың салыстырмалы тығыздығы, өлшемі бірліксіз шама. Мұның мәні – берілген газдың массасы осындай көлемдегі басқа газдың массасына қарағанда неше есе ауыр немесе жеңіл екенін көрсеті. Д – салыстырмалы тығыздықты әдетте сутегі бойынша М(Н2)=2г/моль немесе ауа бойынша Мауа=29г/моль анықтайды. Салыстырмалы тығыздығын біле отырып белгісіз газдың молярлық массасын немесе массасын анықтауға болады: М1=Д*М2 немесе m1=Д*m2
Негізгі әдебиет:[1] – 18-27б; [2] – 14-43б; [3] – 14-16б; 86-87; [4] – 7-19б; [5] – 15-30б; [6] – 17-25б.
Қосымша әдебиет: [8] – 13-27б.
Бақылау сұрақтары:
1. Атом-молекулярлы теориясының негізгі түсініктері.
2. Мынадай түсініктерге анықтама беріңіз: атом, молекула, элемент, ион, жай зат, күрделі зат.
3. Құрам тұрақтылық заңын жазыңыз. Бұл заңның сипаттамасы нені білдіреді?
4. Моль – зат сандары бірліктеріне анықтама беріңіз.
5. Авогадро заңын және оның екі тұжырымдамасын жазыңыз.
6. Менделеева-Клапейрон теңдеуінің формуласын жазыңыз.
7. Т элементінің эквиваленті және күрделі заттың эквиваленті дегеніміз не?
8. Эквиваленттің, қышқылдың, негіздің және тұздың молярлық массасын қалай есептейміз?
9. Эквиваленттер заңын жазыңыз.
ІІІ. Дәріс тақырыбы: Атомдарды құру және химиялық элементтердің систематикасы (2 сағ.).
Дәріс конспектілері:
Ең алғаш рет ғылыми тәжірибеге негізделген атом құрылысының моделін ағылшын физигі Э.Резерфорд 1911 жылы ұсынды. Ол мынадай тәжірибе жасады. Радиоактивті заттан ұшып шығатын α-сәулелерінің жолына өте жұқа металл пластинкасын орналастырды. Бұл пластинканың екі экран соғылған α-бөлшегін санауға мүмкіндік берді. Резерфорд α-сәулелерін жұқа металл пластинкасына бағыттап жібергенде, α-сәулелерінің басым көпшіліг одан өтіп кеткенін, кейбірі бағытын өзгерткенін, ал осы соңғылардың кейбіреуі кері қайтатының байқайды. Резерфорд массасы ауыр заряды оң радиоактивті заттан шапшаң ұшып шығатын (20000км/с) α-бөлшектерінің кері қайтуы оның атомдағы оң зарядты, массасы ауыр бөлшектермен соқтығысуынан деп түсіндірді.
1913 жылы Нильс Бор Резерфордтың ядролық теориясы және неміс ғалымы Планктың сәуле шығарудың кванттық теориясын негізге ала отырып сутегі атомы құрлысының теориясын жасады. Планктың теориясы бойынша заттар энергияны жеке-жеке порциялар-кванттар түрінде сіңіреді, немесе бөліп шығарады. Е=h*V Е-квант энергиясы, V-тербелу жиілігі, h=6,626*10-34Дж*с.
Бор постулаттары.
Бордың І-ші постулатасы: Электрон ядроны кез келген орбита бойынша емес, тек тұрақты (стационар) орбита бойынша айналып жүреді. Бұл тұрақты орбита бойынша айналғанда электрон энергия бөліп шығармайды.
Н. Бор теңдеуіне сәйкес келетін орбиталары кванттық немесе энергетикалық орбиталар немесе деңгейлер дейді.
Бордың ІІ постулаты: Электрон көбірек қозған (жоғарғы деңгейден) күйден азырақ қозған (төменгі деңгейге) немесе қалыпты күйге көшкенде өзіне тән тербелу жиілігі бар сәуле түрінде квант энергия бөлініп шығады.
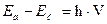
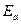 - ядродан қашық деңгейдегі электронның энергия қоры.
- ядродан қашық деңгейдегі электронның энергия қоры.
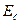 - ядродан жақын деңгейдегі электронның энергия қоры.
- ядродан жақын деңгейдегі электронның энергия қоры.
V – тербелу жиілігі
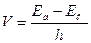
 - Плаж тұрақтысы = 6,626*10-34 Дж/с
- Плаж тұрақтысы = 6,626*10-34 Дж/с
атомдағы деңгейлерден электрон аусуының тербелу жиілігі белгілі болса толқын ұзындығы келесі формуламен есептеледі.
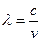
 - толқын ұзындығы.
- толқын ұзындығы.
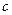 - жарық жылдамдығы.
- жарық жылдамдығы.
 - жиілік (тербелу).
- жиілік (тербелу).
Квант сандары.
Атомдағы электронның күйін толық көрсету үшін квант сандарымен пайдаланады. Квант сандары электрон қозғалысын физикалық тұрғыдан сипаттайды, әрі электрон бултының геометриялық ерекшеліктерін бейнелеп береді.
3) n – бас квант саны орбитальдағы электронның энергиясын және орбитальдың
көлемін көрсетеді.
Ол болады тең: n: 1, 2, 3, 4, 5, 6, 7 …
Энергетикалық деңгейі: K, L, M, N, O, P, Q …
немесе қабат
неғұрлым n, электрон ядродан алысрақ булты да үлкенрек.
4) Электрон булттарының кішінен орбиталь квант саны –1 сипаттайды. Орбиталь
квант саны 0-ден n-1-ге дейінгі аралықтағы бутін сандардың мәніне тең болады: l=0, 1, 2, 3 … n-1 дейін. Оларды s, p, d, f әріптерімен белгілейді.
| n | L | n-1 | Орбитальдарды белгілеу әріптері |
| 0-ге | (1-1)=0 | 1s | |
| 0,1 | (2-1)=1 | 2s2p | |
| 0,1,2 | (3-1)=2 | 3s3p3d | |
| 0,1,2,3 | (4-1)=3 | 4s4p4d4f | |
S – орбитальдардың кеңістіктегі – геометриялық пішіні шар тәрізді сфера.
|
|
 l=0-ге
l=0-ге


p – орбитальдікі гантель тектес, 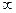 l=1
l=1
ал d, f – орбитальдарыныкі оданда күрделі болады.
d – орбитальдікі
l=2
 | |||
 | |||
5) m – магнит квант саны, бір пішіндес орбитальдардың жалпы санын және олардың
кеңістіктегі орналасу ретін көрсетеді.
Магнит квант саны – l.. 0.. +l аралығындағы бутін сандардың мәніне ие болады. Осыған орай әрбір орбитальквант санына (2l+1) магнит саны сай болады.
| l | m жалпы саны | m |
| 0 (s) | 2*0+1=1 | |
| 1 (p) | 2*1+1=3 | -1; 0; 1 |
| 2 (d) | 2*2+1=5 | -2; -1; 0; 1; 2 |
| 3 (f) | 2*3+1=7 | -3; -2; -1; 0; 1; 2; 3 |
 -l; 0; l
-l; 0; l
l=0 (s) - шарообразную. то m=0
l=1 (p), то m=3 т.е от –1, 0, +1
l=2 (d), то m=5, т.е от –2, -1, 0, +1, +2
l=3 (f) то m=7, т.е от –3, -2, -1, 0, 1, 2,3
6) Спин квант саны – ms электронның өз өсінен қай бағытта айналатынын көрсетеді.
Электрон өз өсінен бір бағытта немесе оған қарсы бағытта қозғалуы мүмкін. Сондықтан  . Электрондар спиндерін стрелкамен белгілейді. Спиндері параллель электрондарды бір жаққа бағытталған
. Электрондар спиндерін стрелкамен белгілейді. Спиндері параллель электрондарды бір жаққа бағытталған 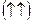 , ал спиндері қарама-қарсыларды екі жаққа бағытталған стрелкалармен
, ал спиндері қарама-қарсыларды екі жаққа бағытталған стрелкалармен  белгілейді.
белгілейді.
Көп электрондарды атомдардағы электрондардың жалпы сипатын анықтау үшін Паули принципін қолданады.
Бір атомда бірдей кванттық күйде болатын электрондар болмайды, немесе кез-келген атомда төрт квант сандарының мәндері бірдей екі электрон болмайды.
Бас, орбиталь, магнит, спин квант сандарының мәндерін және Паули принципін пайдаланып энергетикалық деңгейлер мен деңгейшелердегі электрондардың максимал сандарын анықтауға болады.
1) Бас квант саны – n=1, K – деңгейде S – деңгейшесі бір S - орбитальдан тұратындықтан бұл қабатта  -нан артық болмайды.
-нан артық болмайды.
2) Бас квант саны n=2, сәйкес L деңгейінің бір s; бір p – деңгейшелерінде (n2) 4 орбиталь
болғандықтан, екінші қабаттағы электрондардың ең көп саны (2n2) 8-ге тең болады.
3) Бас квант саны n=3 М – деңгейде, Паули принципіне сәйкес электрондардың саны ең көбі = 
4) Бас квант саны n=4, N – деңгейде 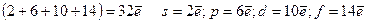
Кезекті электронның энергетикалық деңгейлер мен деңгейшелерде орналасу ретінің бас және орбиталь квант сандарына тәуелділігін Клечковскийдің бірінші және екінші ережелері анықтайды:
Клечковскийдің бірінші ережесі:
Элемент атомының электрондары оның энергетикалық деңгейлерімен деңгейшелерінде бас және қосымша квант сандары қосындысының (n+l)өсу ретімен орналасады.
Ключковскийдің 2 ережесі
Егер екі деңгейше үшін бас және қосымша квант сандарының қосындысы (n+l) бірдей болса, онда электрон алдымен l-дің мәні кіші n-нің мәні үлкен l-дің мәні кіші деңгейшеде орналасады.
Клечковский ережесіне сәйкес келесі тізбекті алуға болады:
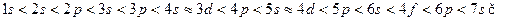
Мысалы: 
4 период ІІ топ
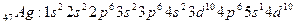
5 период І топ (қосымша).
Паули принципіне сәйкес әрбір орбитальда бір немесе спиндері қарама қарсы екі электрон болады.
Бірнеше орбитальдары бар бір деңгейшеде электрондар орналасу реті Гунд ережесіне бағынады:
Осы деңгейшеде электрондар спин сандарының қосындысы максимал болатындай орналасады немесе әрбір электрон мүмкіндігінше жеке ұяшыққа орналасуға тырысады.
Ядро құрамы
Атом ядросында протон (р) және нейтрондар (n) бар – оларды нуклондар дейді.
Протонның массасы – 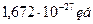 , және заряды +
, және заряды +
Нейтронның массасы -  , заряды – 0. (электрлік бейтарап бөлшек).
, заряды – 0. (электрлік бейтарап бөлшек).
Олардың массалары бірдей деп санауға болады. Осы теория бойынша барлық атомдардың ядролары z протоннан және (A-Z) нейтроннан тұрады, мұндағы Z – элемент. A – массалық саны.
A=Z+N
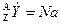
Изотоптар: Бір элементтің әр түрлі атомдарының ядро зарядтары бірдей бірақ массалық сандары әр түрлі болса, олардың изотоптар деп атайды.
Мысалы: Оттектің массалық саны
16, 17, 18 болатын изотоптары бар:
 - орташа атомдық массасы
- орташа атомдық массасы
Элементтің атомдық массасы барлық табиғи изотоптарының таралуын ескерген кездегі олардың массаларынынң орташа мәніне тең.
Исключение: - Жеңіл элементтердің изотоптары.

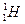 - легкий водород (протий)
- легкий водород (протий)
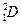 - дейтрий
- дейтрий
 - тритий
- тритий
Изобары: Массылық сандары бірдей болатын әр түрлі элементтердің атомдары – изобаралар деп аталады.
Мысалы: 
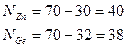
Периодтық заң және Д. И. Менделеев жасаған элементтердің периодтық системасы.
Д. И. Менделеевтің периодтық заңының маңызы өте зор.
Ең алғаш 1869 жылы, одан кейін 1870 және 1871 жылдары Д. И. Менделеев периодтық системамен периодтық заңды ашқандығын орыс және шет ел тілдерінде жариялайды.
Қазіргі кездегі тұжырымдалуы мынадай:
Химиялық элементтердің қасиеттері, сонымен қатар элементтердің қосылыстарының пішіндері мен қасиеттері олардың атомдарындағы ядро зарядының шамасына периодты тәуелділікте болады.
Атом құрлысы теориясы элементтердің қасиеттерінің периодты түрде өзгеруін түсіндіреді. Атом ядросының оң зарядының 1-ден 107-ге дейін өсуі сыртқы энергетикалық деңгейдің құрлысының периодты түрде қайталануын туғызады. Ал элементтердің қасиеттері негізінен сыртқы деңгейдегі электрондардың сандарына байланысты болғандықтан олар да периодты түрде қайталанып отырады.
Периодтық жүйе (ПСЭ) – тұрады – горизоталь қатарлардан – 7 периодтар және 8 вертикаль қатарлар – 8 топтардан. Периодтың нөмірі – бас квант санымен сәйкес келеді Менделеев кестесінде 7 период – бас квант санының 7 мәніне сәйкес келеді.
1, 2, 3 – кіші периодтар.
4, 5, 6, 7 – үлкен периодтар (2-қатардан тұрады).
І периодта – 2s – элемент, ІІ, ІІІ периодта – 2s+6p элемент= 8 элемент
4,5 периодта – 2s+10d+6p=18 элементтен
6 период – 2s+10d+14f+6p=32 элементтен
7 период – 2s+14f+3-4d-эл – толмаған
8 вертикаль қатарлар (тік) – ол 8 топ
1) s және p – элементтердің топтағы орналасуы сыртқы квант қабатының топтағы орналасуы сыртқы квант қабатының 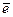 -дар санымен анықталады. Мысалы:
-дар санымен анықталады. Мысалы: 
2) d – элементтердің топтағы орналасуы сыртқы қабаттағы s – элементтер және сырттан ішкі қабаттағы d – элементтер сандарының қосындысымен анықталады. Мысалы: 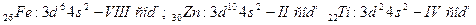
4f элемент; 5f элемент – ІІІ топқа кіреді (La, Ac). Топтар топшаларға бөлінеді: (негізгі және қосымша топшалар) негізгі топшалаға s және p – элементтер, ал қосымша топшаларға d және f элементтер кіреді, кіші периодтар тек қана s және p – элементтерден тұрады (негізгі топтардың элементтері).
1) горизонталь бағыты бойынша элементтердің қасиеттерінің өзгеруі – периодта солдан оңға қарай металдың қасиеттер әлсірейді де, бейметалдық қасиеттері күшейеді.
2) вертикаль бағыты бойынша (негізгі топшаларда) – жоғарыдан төменге қарай – металдық қасиеттер күшейеді ал, бей металдық қасиеттері - әлсірейді.
Атомдардың қасиеттерінің периодтылығы.
Атомдардың мынадай қасиеттері: шамасы, иондану энергиясы, электрон тартқыштылығы, электртерістігі, тотығу дәрежесі сол атомдардың электрондық конфигурациясымен байланысты. Элементтің рет номері өскен сайын, олардың өзгеруіне периодтылық байқалады.
1) Иондану энергиясы: - бұл атомнан әлсізірек байланысқан электронды жұлып алуға қажет энергия. Атомнан электронды жұлып алған кезде өзіне сәйкес түзеді. Мысалы:

Ол әдетте электрон-вольтпен өрнектеледі. (Э/вольт). J (иондану энергиясы) – атомның тотықсыздандырғыштық қасиетін көрсетеді, J азайғансайын, тотықсыздандырғыш қасиет артады. 
2) Атомдар тек электронды беріп қана қоймайды, сонымен қатар қосып та алады. Бұл кезде сәйкес анион түзіледі. Атомға бір электрон қосылған кезде бөлінетін энергияны электрон тартқыштық деп атайды. Ол да электрон-вольтпен өрнектеледі (Э/вольт).
Е - әрпімен белгілейді.
Е – атомның тотықтырғыштық қасиетін көрсетеді.
3) Электротерістік анықтамасын 1932 жылы американ ғалымы Л. Поминг берді.
Электртерістік дегеніміз молекуладағы атомның электрондарды өзіне тарту қабілеті. Ол иондану энергиясымен Е электрон тартқыштыққа тәуелді. 
 - периодпен өседі, топтармен азаяды.
- периодпен өседі, топтармен азаяды.
4) Атом радиусы – оның маңызды сипаттамасы. Атом радиусы үлкен болған сайын сыртқы электрондардың байланысы элсірей түседі және керісінше, атом радиусы кішірейген сайын электрондардың ядроға тартылуы күшейе түседі.
Периодта атом радиусы солдан оңға қарай кішірейеді.
Топшаларда жоғарыдан төмен қарай радиусы үлкейеді.
Негізгі әдебиет: [1] – 36-37б; 59-65б; [2] – 65-96б. [3] – 17-34б; [4] – 34-55б; [5] – 48-93б; [6] – 46-73б
Қосымша әдебиет: [8] – 30-48б.
Бақылау сұрақтары:
1. Атомдағы электрондар күйін қалай толық түрде жазуға болады?
2. Кванттық сан деп нені айтамыз және ол қалай беріледі?
3. Берілген энергетикалық деңгейдің электрондар сандары мен орбитальдар саны немен анықталады?
4. Паули принципі нені білдіреді? Ол қандай күрделі мәселелерді қарастырады?
5. Периодтық заңның қазіргі кездегі түсініктемесін беріңіз.
6. Келесілерді біле отырып атомға қандай сипаттама беруге болады: а) элементтің реттік нөмірі; б) период нөмірі; в) топ нөмірі?
7. Элементтердің күйлеріндегі периодтық қайталаманы олардың атомдарының электрондық құрылуы көзқарасы бойынша қалай түсіндіруге болады?
ІV. Дә ріс тақырыбы: Химиялық байланыс (1 сағ.).
Дәріс конспектілері:
Валенттік байланыс әдісі (ВБӘ).
Химиялық байланыс жөнінде көзқарас екі бағытта дамыған:
1) Косселдің электростатикалық теориясы: химиялық байланыс әр түрлі зарядталған иондардың тартылуы нәтижесінде түзіледі.
2) Льюс теориясы: химиялық коваленттік байланыс атомдардың жалпы электрондық жұптары арқылы түзіледі (1916ж)
Льюс көзқарасын ғалым Полинг дамытқан және де валенттік байланыс әдісі (ВБӘ) теориясының негізіне енген. Бұл теория бойынша байланыс антипараллельді спинді элементтер жұбының арасында іске асырылады. Жоғары электрондық тығыздық екі атом ядросын байланыстырады.
Химиялық байланыстың негізгі сипаттамалары:
1. Байланыс ұзындығы – химиялық байланысқан атомдарының ядроларының ең қысқа аралығы.
2. Байланыс энергиясы – байланысты үзу үшін қажет энергия мөлшері. Байланыс энергиясы оның беріктігінің өлшемі, үлкен байланыс энергиясына қысқа ұзындығы сәйкес келеді, мысалы:
| HF | HCl | HBr | HІ | |
| E, кДж/моль | ||||
| d, нм (1нм=10-9М) | 0,092 | 0,128 | 0,141 | 0,160 |
3. Байланыс полюстігі – электрон жұбының бір атомға ығысуына негізделген (ковалентті полюсті, ионды).
4. Байланыстың қанығуы – белгілі бір шекті химиялық байланыс саны түзілу қабылеттілігі.
5. Байланыстың бағытталуы, яғни химиялық байланыс түзетін атомдардың кеңістікте өзара орналасуы, бұған молекула формасы тәуелді: сызықтық, бұрышты, үш бұрышты, тетраэдрлік және т.б.
Химиялық байланыстың түзілу механизмі.
Жалпы электрон жұбының түзілу-алмасу механизмі бойынша іске асырылады: әр атом – сыңарына бірден-бір тақ электронын ұсынады (береді) немесе донорлы-акцепторлы механизмі бойынша: бір атом (донор) жұп электронын береді, ал екіншісі (акцептор) валенттік бос орбиталін ұсынады.
Атомдық валенттік-қозған күйі.
Элементтердің валенттік мүмкіндігі тақ электрондар санымен анықталынады. Элементтердің жоғары валенттілігі бір энергетикалық деңгейдегі электрондардың басқа деңгейшелерге ауысып, жұпсыздануымен іске асырылады.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 1750; Нарушение авторских прав?; Мы поможем в написании вашей работы!