
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Дебиеттер тізімі 6 страница
|
|
|
|
Аммиак синтезі NH3 төменгі температурада (DН<0) толығырақ жүреді. Дегенмен төменгі температурада тепе-теңдік жағдайға келу баяу жүреді, сол себептен қыздыру керек. Өте қатты қыздыру аммиактың диссоциасын күшейтеді. Қыздыруды жүйеде қысымды арттырумен алмастыруға болады.
Негізгі әдебиет: [1]- 167-182б; 183-212б; [2] – 152-169б; 172-197б; [3] – 115-141б, 166-182б, 195-200б; [4] – 129-136б, 166-190б; [5] –35-47б, 166-193б; [6] –195-231б, 238-259б.
Қосымша әдебиет: [8] – 19-20, 27-30б.
Бақылау сұрақтары:
1. Термодинамиканың І заңын жазыңыз.
2. Күйдің термодинамикалық функцияларын атаңыз және нені сипаттайды?.
3. Термодинамиканың ІІ заңының мәні неде?
4. Изобарлы-изотермиялық жағдайда химиялық реакциялардың ағуының критерийлерін атаңыз.
5. «Химиялық реакциялардың жылдамдығың деп нені айтамыз және ол қандай факторларға тәуелді?
6. Аа Вв = Cc + Dd химиялық реакциясына «Әрекеттесуші массаларң заңын жазыңыз.
7. Вант-Гофф ережесі мен Аррениус теңдеуін жазыңыз.
8. Активті энергия дегеніміз не?
9. Ле-Шателье принципін жазыңыз.
10. Химиялық теп-теңдіктің араласуы қандай факторларға тәуелді?
VІ. Дәріс тақырыбы: Ертінділер (3 сағ.).
Дәріс конспектілері:
Ертінділер деп екі немесе одан да көп (құрауыштардан) компоненттерден тұратын тепе-теңдіктегі гомогенді жүйені айтады.
Жүйе деп қоршап тұрған ортада беткей арқылы бүлініп тұрған компоненттерді (құрауыштарды) айтады.
Мысалы: стакандағы, колбадағы, пробиркадағы тұздардың, қышқылдардың, сілтілердің және т.б. заттардың ертінділері. Ертінді екі компоненттен тұрады: еріткіш және ерітінді зат. Жүйедегі қайсы компонент көп мөлшерде болса, онда ерігенге дейін де және ерігеннен кейін де өзінің агрегаттық күйін өзгертпейтін компонент еріткіш болады. Мысалы: NaCl тұзының ертіндісі: Су - еріткіш, NaCІ - еріген зат. Немесе, 96% этил спирті: С2Н5ОН - 96% және H2O - 41%, яғни C2H5OH - еріткіш, H2O - еріген зат.
Ертінділердің химиялық теориясын Д.И. Менделеев жасаған. Еру - еріткіш пен еріген заттың химиялық әрекеттесуі. Ерудің химиялық процесс екендігін мыналар көрсетеді: 1) энергияның бөлінуі немесе сіңірілуі (күкірт қышқылы ерігенде энергия бөлінеді, ертінді қызады); 2) суда еріген тұздың түсінің өзгеруі (CuSO4 - ақ түсті, CuSO4*5H2O – көкшіл түсті); 3) көлемінің өзгеруі (96% 100 мл C2H5OH 100 мл H2O да ерігенде көлемі 200 мл-ден аз болады).
Ертіндінің түзілуі ешқандай әсерсіз өзбетінше тұрақты тепе-теңдік орнағанша жүреді. Еруді туғызатын күш ертіндінің бос энергиясының DG азаюы (изобаралы - изотермиялық потенциялдық) болып есептеледі.
DGжүру - DGалғ<0
Егер процесс аяқталса, онда DG=0, яғни тепе-теңдік орнайды. Ертіндінің түзілу энтальпиясы төмендеуі мүмкін - экзотермиялық процесс, немесе жоғарылауы мүмкін - эндотермиялық процесс. Ертініді түзілгенде энтропия DS өзгереді.
Еру кезіндегі химиялық реакция молекулалардың немесе иондардың гидратациясы, яғни әрбір бөлшек n-H2O молекуласымен қоршалған жаңа гидратталған бөлшек түзеді. Бұл жағдай бос су молекуласының концентрациясының азаюына әкеліп соғады. Бұл процесстер экзотермиялық немесе эндотермиялық болуы мүмкін. Еріген кезде заттар молекулалық немесе иондық күйге дейін ыдырайды (дисперсияланады). Бұл біртекті немесе гомогенді ертінділер. Мысалы: қышқылдардың, сілтілердің, суда жақсы еритін тұздардың ертінділері. Егер зат тұнбаға түссе, онда екі фазадан: қатты және сұйық, тұратын гетерогенді жүйе түзіледі. Бұл жүйеде зат молекулалық немесе иондық күйге дейін дисперсияланады (өзгереді) және ертінді компоненттері көпке дейін бір-бірімен тепе-теңдік күйде сақталады. Егер еріткіш ретінде сұйық компонент (су немесе органикалық еріткіштер) алынса, онда еритін зат ретінде газ күйінде, сұйық немесе кристалл заттар болуы мүмкін. Бірнеше жүйе түзіледі: сұық-газ, сұйық-сұйық, сұйық-қатты зат.
Сұйық-газ жүйесі. Газ күйіндегі заттардың суда еруі газ молекуласындағы химиялық байланыстың түріне байланысты болады. Мысалы: O2, H2, N2 және т.б. ковалентті полюссіз байланыс, ал Н2О - полярлы байланыс, еріткіш. Сондықтан полярлы еріткіште байланысының түрі полярсыз газ күіндегі заттар аз ериді. Ал байланыс түрі полярлы газ күйідегі заттар HCІ, NH3 және т.б. полярлы суда шексіз ериді. Яғни, еріткіш пен еритін заттың байланыс түрі бірдей болса (полюсті-полюсті), онда еру шексіз болады, ал бірдей болмаса (полюсті-полюссіз) еру өте аз болады.
 Қалыпты жағдайда 1л Н2О ерігіштік
Қалыпты жағдайда 1л Н2О ерігіштік
Полюсті Полюссіз
 NH3 1 300 000 см3 О2 49,2 см3
NH3 1 300 000 см3 О2 49,2 см3
 HCІ 507 000 см3 Н2 21,5 см3
HCІ 507 000 см3 Н2 21,5 см3
Газ күйіндегі заттардың ерігіштігі қысымға және температураға байланысты. Қысым жоғарылаған сайын ерігіштік те өседі. Генри заңының көрінісі: С=АКР. Ерігіштіктің температураға байланыстылығы керісінше, температура жоғарылаған сайын ерігіштік кемиді. С=В/Т. Сұйықтық-сұйықтықта да ерігіштік химиялық байланыстың табиғатына байланысты. Егер байланыс түрі бірдей болса, онда ерігіштік шексіз болады. Мысалы: Н2О - С2Н5ОН. Ал егер әртүрлі болса - екі қабатты сұйықтық түзіледі, және ерігіштік шектелген (аз) болады. Мысалы: Н2О - С6Н6.
Сұйықтық - қатты зат жүйесіндегі ерігіштік көп факторларға байланысты: кристалдық тордың ыдырауы, диссоциациялану, гидраттану энергияларына, және т.б. Сондықтан бұл жүйеде ешқандай заңға бағыну жоқ.
Еріткіштің табиғатының еру процесінде үлкен ролі бар. Еріткіштің ең маңызды қасиетіне оның диэлектрлік өткізгіштігі “Е” мен құрылысы жатады. “Е” - еріткіштің полюстігімен молекуласының көлемінің функциясы. Неғұрлым еріткіштің полярлылығы мен молекуласының деформациялану қасиеті жоғары болса, онда соғұрлым оның диэлектрлік өткізгіштігі де жоғары болады. Судың “Е” ең жоғары, ол 78,3 ке тең, сондықтан су ең көп тараған еріткіш.
Ертіндінің құрамын көрсету
Ертіндінің құрамын әртүрлі әдіспен көрсетуге болады:
1) Массалық үлес 100 г. ертіндіде еріген заттың %-пен берілген массасы. Мысалы: Массалық үлесі 20% ертінді дегеніміз, 80 г. суда 20 г. зат еріген деген сөз, ал ерітіндінің жалпы массасы 100 г.
Есеп: Массалық үлесі 15% 400 г. ертінді дайындау үшін керек сілтінің массасын табу керек.
Шығару жолы: 100 г. ертіндіде 15 г. сілті бар
ал 400 г. ертіндіде Х г. сілті бар.
Х=400*15/100=60 г.
2) Ертіндінің молярлығы М, 1л ертіндідегі заттың (молінің) мөлшері. Моль - 1л - 1М, 0,1 моль - деци, 0,01 моль - санти, т.б.
Есеп: 600 мл 0,15 М ертінді дайындау үшін керек NaCl массасын табыңыз.
Шешуі: MNaCІ=58.5 г. 1М - 1л - 58,5 г.
0,15М - 0,6л - -Х г.
яғни, m=M*VC=58,5*0,15*0,6=5,265 г.
3) Ертіндінің нормальділігІ - N, 1л ертіндідегі еріген заттың эквивалент мөлшері.
Экв - 1л -1 N ерітінді.
Есеп: 400 мл 0,25 N ертіндіні дайындау үшін керек H2SO4 массасын табыңыз.
MH2SO4=98 г. 49 г. -1л - 1N m=Экв*Vc=49*0,4*0,25=4,9 г.
ЭквH2SO4=49 г. Х г. - 0,4л - 0,25N
4) Ертіндінің моляльдығы - m, 1000 г. H2O-дағы еріген заттың (молінің) мөлшері.
Мысалы: 3m H2SO4 дегеніміз, 1000 г. H2O-да 3 моль 100% H2SO4 бар деген сөз.
5) Ертіндінің титрі, 1 мл ертіндідегі еріген заттың (г) мөлшері. Титр нормальділіктің эквивалентке көбейтіндісіне тең болады.
Т=N*экв/1000
Ертінділердің қасиеттері. Осмос қысымы.
Еріген кезде судың бос молекулаларының концентрациясы азаяды. Себебі, су еріген заттың гидратталған қабатына кіреді. Егер концентрациясы әртүрлі екі ертіндіні қосса, мысалы жартылай өткізгіш қабырға арқылы қант ертіндісін қоссақ, онда қант концентрациясы аз жағындағы су концентрациясы көп жағына ауысады. Судың бұл ауысуы қанттың гидратталуына және концентрациясы көп жағында бос судың жетіспеушілігіне байланысты жартылай өткізгіш қабырға арқылы су молекулаларының бір жағынан екінші жағына ауысуы «осмосң деп аталады, ал қабырғаға қосымша гидростатикалық қысым «осмос қысымың деп аталады.
Мысалы: Ортасында жартылай өткізгіш қабырғасы бар үш ыдыс аламыз, су молекулалары қабырға арқылы оңай өте алады.
|
 | |||||
 | |||||
 | |||||
|
|
|
|
|
|
|
|


 І
І
 | |||||
 |  |
І-жағдай: қант концентрациясы жоғары және төменгі бөлігінде бірдей С1=С2. Төменнен жоғары және жоғарыдан төмен қабырғаға қысым C2 бірдей, яғни тепе-теңдік күйде болады.
ІІ-жағдай: қант концентрациясы әртүрлі C1>C2. C1>C2 болғандықтан ыдыстың жоғарғы бөлігінде гидратталу үшін су молекулалары жетіспейді, сондықтан олар төменгі бөліктен жоғары бөлікке өтеді. Жоғарғы бөліктегі ертінді ІІ С1 көлемі өседі де6 бөліп тұрған қабырғаға түсірген С2 қосымша гидростатикалық күші осмос қысымы болып есептелген.
ІІІ-жағдай: C1<C2, яғни ІІ-шіге қарама-қарсы. ІІІ С1 Төмендегі бөліктің көлемі көп болғандықтан қосымша қысым төменнен жоғары жүреді.С2
Концентрация айырмашылығы неғұрлым көп болса, соғұрлым осмос көп болады яғни, осмос қысымы да көп болады. Сонымен осмос қысым концентрацияға байланысты. Ал молекулалардың кинетикалық қозғалысы температураға байланысты. Неғұрлым температура жоғары болса, соғұрлым молекулалар ағысы да жоғары болады, яғни осмос жоғары болады. Сондықтан осмос қысымы да температураға байланысты болады. Бұл байланыс Вант-Гофф заңы деп аталады, көрінісі мынадай:
Росм=CRT.
Электролит емес ертіндінің осмос қысымы молярлық концентрациясы мен абсолюттік температурасына тура пропорционал болады. Әсер ету механизмі жағынан осмос қысымы газ күйіндегі жүйенің қысымына ұқсас. Сондықтан осы екі жүйені салыстыра келіп Вант-Гофф осмос қысымына мынадай анықтама береді.
Электролит емес сұйытылған ертіндінің осмос қысымы еріген заттың түсірген қысымына тең болады, егер ол дәл сол температурада газ күйінде болса және оның көлемі ертінді көлемімен бірдей болса, онда формулаға Росм=CRT молярлық концентрация кіретін болғандықтан, ертіндінің осмос қысымы арқылы еріген заттың молекулалық массасын табуға болады. Осмос қысымы мен осмос табиғатта кең таралған - бұл барлық өсімдіктер мен жан-жануарлар организмінің (ағзасының) өмір сүруі, атап айтқанда керек затты (тамақ) сіңіру клетканың су балансын реттеу нәтижесінде жүреді.
Ертіндінің бу қысымының төмендеуі. Раульдің бірінші заңы
Фазалардың (сұйықтық-газ) бөліну шекарасында екі құбылыс пайда болды - булану-концентрациялану (қайтадан сұйықтыққа айналу). Еріткіш молекулалары буланып газ күйіне өтеді де ерітінді бетінде белгілі мөлшерде су буынының қысымын туғызады. Бу сұйықтыққа конденсацияланып қысымды төмендейді. Ең соңында белгілі температурада (25О С немесе 298О К) булану-конденсациялану, тепе-теңдігі орнайды да су буының қысымы (яғни еріткіштің) тұрақты болды. Оны РО деп белгілейміз. Егер сол температурада бір буға айналмайтын (мысалы, қант) электролит емес заттың ерітсе, онда қанттың гидратталған молекулалары ерітіндінің барлық көлемінде және беткейінде жайылып булану беткейін жабады да судың булану алаңы кемиді. Сонымен дәл сол уақыт мөлшерінде және дәл сол температурада ерітіндінің беткейінен судың аз молекуласы буланады да будың қысымы кемиді. Сондықтан ертіндінің бу қысымы барлық уақытта таза ерткіш қысымынан аз болады. Ертіндінің бу қысымын Р-деп белгілейміз. Таза ерткіш қысымына РО салыстырылып алынған қысымдар “РО-Р” айырмашылығы «ертіндінің бу қысымының салыстырмалы төмендеуің деп аталады, яғни РО-Р. Ол еріген зат концентрациясына байланысты, ол неғұрлым көп болса, соғұрлым төмендеуі де көп болады.
Раульдің І-заңы: сұйытылған элекролит емес ертінділер үшін ертінді буының қысымның салыстырмалы төмендеуі буланбайтын еріген заттың мольдық үлесіне тең болады, РО-Р/Р=М2.
Электролит емес ертінділердің қату төмендеуі және tО қайнау жоғарылайды. Раульдің ІІ заңы.
Кез келген таза еріткіш секілді судың қату және қайнау температурасы бар. Егер қысым қалыпты болса, яғни 101325Па-тең болса, су tО=100О С қайнайды, tО=0О С қатады. Су күйінің диаграммасында ол ОА қисығы арқылы көрсетілген. Ол қалай жүрді? Су буының қысымы атмосфералық қысымға тең болған А кезде фазалардың сұйықтық-газ
|
|





 101,325 А1
101,325 А1
|
 |
00 1000 С
шекарасы жоғалады да, су молекулалары сұйық күйде газ күйге және керісінше оңай өтеді, сол кезде су қайнайды. Егер су суыса, онда конденсациялану процесі өседі де, газ күйіндегі су мөлшері азаяды және су буының да қысымы төмендейді. Су буының қысымы өте аз болғанда және мұз кесегі (куб) үстіндегі қысыммен теңескен кезде, су кристаллданады. Бұл 00С және қысым 4,6 мм. сынап бағанасына тең болғанда, мұз бетіндегі су буында болады. Егер суда буға айналмайтын электролитті ерітсе, мысалы қантты, Раульдың І заңы бойынша ертінді буының қысымы төмендейді. Енді атмосфералық қысымға жету үшін ертіндіні қосымша қыздыру керек, сонда температура көтеріледі, О1 А1 қисығы. Еріген зат концентрациясы неғұрлым көп болса, соғұрлым ертінді буының қысымы көпке төмендейді де, ерітіндінің қайнау температурасы жоғары болады. Бұл байланыс Раульдың ІІ заңымен көрсетіледі және көрінісі мынадай: Dt0қайнау =Е*m
Dt0қату=к*m,
мұндағы Dt - температураның жоғарылауы немесе төмендеуі, Е=эбулиоскопиялық (қайнау) констатасы; К - криоскопиялық (қату) константасы; m-еріген заттың моляльдық концентрациясы
.m=m1*1000/M*m2
мұндағы m1,m2 - еріген зат пен еріткіштің массасы; М - еріген заттың молярлық массасы 1000г. - су массасы.
Заңның көрінісі:
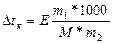 (эбулиоскопиялық әдіс)
(эбулиоскопиялық әдіс)
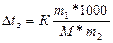 (криоскопиялық әдіс)
(криоскопиялық әдіс)
Ертінділердің қайнау температурасының өсуі (қату температурасының төмендеуі) еріген заттың моляльдық концентрациясына тура пропорционал болады. Раульдің ІІ заңы бойынша белгісіз заттардың молекулалық массасын табуға болады.
Вант-Гофф және Рауль заңдары тек ертіндіде (бөлшек) молекула сандары тұрақты сұйытылған электролит емес ертінділерге қолданылады. Молекулалары ионға жартылай ыдырайтын (диссоциацияланатын) электролит гидратталған бөлшектердің саны өзгереді, ол диссоциациялану дәрежесіне және концентрацияға байланысты болады. Сондықтан ертінділердің қасиеттерін сипаттайтын заңдар теориялық байланыстардан бөлек болады және изотоникалық коэффициент “і” енгізіледі.
Электролиттік диссоциация теориясы
Судағы ертінділері немесе балқымалары иондарға ыдырайтын және электр тоғын өткізетін заттарды электролиттер деп атайды.
Иондарға толық ыдырайтын электролиттерді «күшті электролиттерң деп, жартылай ыдырайтын электролиттерді «орташаң немесе «әлсіз электролиттерң деп атайды.
Электролиттерге қышқылдардың, негіздердің және тұздардың судағы ертінділері жатады. Диссоциация кезінде оң зарядталған катиондар және теріс зарядталған аниондар түзіледі. Мысалы:
HCІ=H++Cl-
NaOH=Na++Cl-
AgNO3=Ag++NO3-
Иондардың барлығы гидратталған, бірақ жазуға оңай болу үшін гидратталған қабаттар жазылмайды.
Күшті электролиттер ертінділерінде тек иондар болады, молекулалар болмайды. әлсіз электролиттердің ертіндісінде иондармен бірге молекулалар да болады, сондықтан бұларда диссоциациялану процесі қайтымды, тепе-теңдік күйде болады және сатылап жүреді. Мысалы:
1) Көмір қышқылының диссоциациясы

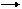 H2CO3 H++HCO3-
H2CO3 H++HCO3-
2) мыс гидроксидінің диссоциациясы
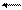
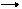 Cu(OH)2 CuOH++OH-
Cu(OH)2 CuOH++OH-
Әлсіз көп негізді қышқыл мен негіздердің сатылап диссоциацияланғанда гидро-аниондар мен гидроксо-катиондар түзіледі. Электролит күшін ток өткізгіштігіне қарап анықтайды:
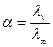
lv – заттың берілген сұйылту кезіндегі эквиваленттік электр өткізгіштігі
l¥ - заттың шексіз сұылту (V®¥) кезіндегі электр өткізгіштігі
Электрөткізгіштік иондардың санына байланысты болғандықтан диссоциациялану дәрежесін иондарға ыдыраған молекулалар санына қатынасы арқылы табады.
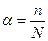
a-ны сандық үлеспен немесе пайызбен көрсетуге болады. Шексіз сұйылту кезінде a=1 немесе 100% болады.
Әлсіз электролиттердің диссоциациясы қайтымды, яғни иондар өз молекулаларымен тепе-теңдік күйде болады. Сондықтан мұндай реакцияларға тепе-теңдік константасын жазуға болады, ол диссоциациялану константасы деп аталады. Мысалы:

 Н2СО3 Н++НСО3-1(1 сатысы).
Н2СО3 Н++НСО3-1(1 сатысы).
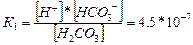
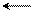
 HCO3- H++CO3-2
HCO3- H++CO3-2
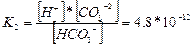 (2 сатысы)
(2 сатысы)
Диссоциациялану константасы неғұрлым аз болса, соғұрлым электролит әлсіз болады. Осындай диссоциациялану константалары әлсіз, бірақ аз диссоциацияланатын электролиттерге табылған. Тұнбаға түсетін электролиттер, яғни аз еритін қосылыстар үшін басқа өлшем бірлігі қолданылады, ол еру көбейтіндісі ЕК деп аталады, мысалы:

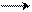 AgCl¯ Ag++Cl-
AgCl¯ Ag++Cl-
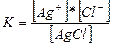
Бірақ тұнбадағы [AgCl] концентрациясы енді өзгермейді, сондықтан оны тұрақты бірлік ретінде сол жаққа ауыстыруға болады. К*[AgCl]=[Ag+]*[Cl-], K*[AgCl]=EK. Осыдан ЕК=K*[AgCl]. «ЕКң және «Кң оқу құралдарында кесетеде берілген.
Электролиттер күшін білу иондық және гидролиз жүргендегі химиялық реакциялардың теңдіктерін жазуға керек. Электролиттердің күшіне байланысты реакциялар аяғына дейін жүреді – қайтымсыз реакциялар және аяғына жетпейді – қайтымды реакциялар. Қайтымсыз реакциялардың бірнеше жағдайлары бар.
1. Әлсіз электролит – су түзілуі, нейтральдау реакциялары:
2NaOH+H2SO4=Na2SO4+2H2O
2Na++2OH-+2H++SO4-2=2Na++SO4-2+2H2O. K=1.8*10-16
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 1053; Нарушение авторских прав?; Мы поможем в написании вашей работы!