
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пример 5
|
|
|
|
На каком основании хлор и марганец помещают в одной группе периодической системы элементов? Почему их помещают в разных подгруппах?
Р е ш е н и е. Электронные конфигурации атомов:
Cl 1s22s22p63s23p5 ; Mn 1s22s22p63s23p63d54s2
Валентные электроны хлора - 3s23p5 , а марганца - 3d54s2 ; таким образом, эти элементы не являются электронными аналогами и не должны размещаться в одной и той же подгруппе. Но на валентных орбиталях атомов этих элементов находится одинаковое число электронов – 7. На этом основании оба элемента помещают в одну и ту же седьмую группу периодической системы, но в разные подгруппы.
Вариант 1.
1. Запишите краткую электронную конфигурацию элементов с порядковыми номерами №2 и №89.
2. Назовите элементы – электронные аналоги с формирующим электроном 5p6 и 6s2.
Вариант 2.
1. Запишите краткую электронную конфигурацию элементов с порядковыми номерами №54 и №17.
2. Назовите элементы – электронные аналоги с формирующим электроном 4f7 и 2p3.
Вариант 3.
1. Запишите краткую электронную конфигурацию элементов с порядковыми номерами №77 и №21.
2. Назовите элементы – электронные аналоги с формирующим электроном 2s1 и 3d2
Вариант 4.
1. Запишите краткую электронную конфигурацию элементов с порядковыми номерами №12 и №46.
2. Назовите элементы – электронные аналоги с формирующим электроном 3d5 и 6s1.
Вариант 5.
1. Записать электронные формулы атомов элементов с зарядом ядра: а) 8; б) 15. Составить графические схемы заполнения электронами валентных орбиталей этих атомов.
2. Указать особенности электронных конфигураций атомов меди и хрома. Сколько 4s-электронов содержат невозбуждённые атомы этих элементов?
Вариант 6.
1. Записать электронные формулы атомов элементов с зарядом ядра: а) 18; б) 23; д) 53. Составить графические схемы заполнения электронами валентных орбиталей этих атомов.
2. Структура валентного электронного слоя атома элемента выражается формулой: а) 5s25p4; б) 3d54s1. Определить порядковый номер и название элемента.
Вариант 7.
1. Записать электронные формулы атомов элементов с зарядом ядра: а) 53; б) 20. Составить графические схемы заполнения электронами валентных орбиталей этих атомов.
2. Назовите элементы – электронные аналоги элементу с формирующим электроном: 4s2 и 5d3.
Вариант 8.
1. Сколько неспаренных электронов содержат невозбуждённые атомы: а) В; б) S?
2. Назовите элементы – электронные аналоги элементу с формирующим электроном: 5d1 и 3p6.
Вариант 9.
1. Сколько неспаренных электронов содержат невозбуждённые атомы: а) As; б) Cr?
2. Назовите элементы – электронные аналоги элементу с формирующим электроном: 4d3 и 2p2.
Вариант 10.
1. Сколько неспаренных электронов содержат невозбуждённые атомы: а) Hg и б) С?
2. Назовите элементы – электронные аналоги элементу с формирующим электроном: 3d10 и 6s1.
Описание химической связи в любой молекуле – это описание распределения в ней электронной плотности. По характеру этого распределения химические связи подразделяют на ковалентные, ионные и металлические.
Ковалентная связь
При рассмотрении природы ковалентной связи используются два подхода: метод валентных связей (МВС) и метод молекулярных орбиталей (ММО).
В основе МВС лежат следующие положения:
1. Химические связи между атомами осуществляются за счёт общих электронных пар в поле обоих ядер. Образование пары электронов возможно за счёт перекрывания облаков электронов с противоположными спинами.
Такая электронная пара может быть образована как в результате спаривания двух неспаренных электронов, принадлежащих разным атомам (обменный механизм), так и за счёт пары электронов одного атома – донора и вакантной орбитали второго атома – акцептора (донорно-акцепторный механизм образования связи).

|
Например, три ковалентные связи в молекуле аммиака образуются по обменному механизму за счёт перекрывания электронных облаков трёх атомов водорода и трёх p-электронов атома азота:
Пара s-электронов атома азота не участвует в образовании связи. При образовании иона аммония четвёртая ковалентная связь между атомом азота и протоном образуется по донорно-акцепторному механизму – за счёт неподеленной пары электронов атома азота (донора электронов) и свободной орбитали иона водорода (акцептора электронов):
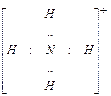
В ионе аммония все четыре ковалентные связи равноценны несмотря на различные механизмы образования.
2. Ковалентная связь может быть полярной и неполярной. Связь между атомами одного элемента всегда неполярна. Связь между атомами различных элементов всегда полярна. Для характеристики способности атома данного элемента оттягитвать к себе электроны, образующие связь, пользуются значением относительной электроотрицательности. Полярность связи обусловлена смещением связующего электронного облака в сторону более электроотрицательного атом.
Например, в молекуле HCl связующее электронное облако смещено в сторону атома хлора. Вследствие этого атом водорода в молекуле HCl поляризован положительно, а атом хлора – отрицательно.
Мерой полярности связи служит электрический момент диполя μсв, равный произведению эффективного заряда δ на длину диполя связи l д связи.
Полярность молекул характеризуется значением электрического момента диполя μм, который равен векторной сумме электрических моментов диполей связей, имеющихся в молекуле.
В линейных молекулах АВ2,треугольныз АВ3, тетраэдрических и квадратных АВ4 дипольные моменты связей А-В взаимно компенсируют друг друга, суммарные дипольные моменты молекул равны нулю. Подобные молекулы неполярны, несмотря на полярность отдельных связей.
3. Ковалентная связь характеризуется насыщаемостью, направленностью и поляризуемостью.
Насыщаемость ковалентной связи проявляется в том, что атом каждого элемента может образовывать ограниченное число ковалентных связей. Максимальная валентность (способность образовывать определенное количество ковалентных связей) определяется числом валентных одноэлектронных облаков (для образования связей по обменному механизму), а также числом свободных валентных орбиталей и двухэлектронныхоблаков (для образования связей по донорно-акцепторному механизму).
Число неспаренных электронов в атоме в процессе образования связей может увеличиваться за счёт возбуждения атома, при котором двухэлектроннные облака распадаются на одноэлектронные и электроны промотируют на свободную орбиталь того же энергетического уровня.
Например, электронная конфигурация и валентность углерода в основном и возбуждённом состояниях следующее:
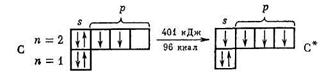
|
В=2 В=4
Направленность ковалентной связи обусловлена различием формы и взаимной направленностью в пространстве электронных облаков. Если у атома, вступающего в химическую связь, участвуют разные атомные орбитали (s-, p-, d- и f-), то при образовании химической связи происходит гибридизация (смешение, выравнивание по форме) этих орбиталей, т.е. из разных атомных орбиталей образуются одинаковые атомные орбитали. Гибридизация происходит у орбиталей, имеющих энергетическую близость. Гибридное облако имеет большую вытянутость по одну сторону от ядра, поэтому при взаимодействии её с атомной орбиталью другого атома происходит максимальное перекрывание. Гибридизация связана с энергетическим выигрышем за счёт образования более прочных связей и более симметричного распределения электронной плотности в молекуле.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 1271; Нарушение авторских прав?; Мы поможем в написании вашей работы!