
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
И углы между связями. Типы гибридизации, геометрическая форма частиц Гибридизация Геометрическая форма Угол между связями sp линейная (BeH2) 180о
|
|
|
|
Типы гибридизации, геометрическая форма частиц
| Гибридизация | Геометрическая форма | Угол между связями |
| sp | линейная (BeH2) | 180о |
| sp2 | треугольная (BF3) | 120о |
| sp3 | тетраэдрическая (NH4+) | 109о28/ |
| sp3d | тригонально-бипирамидальная (SF4) | 90о,120о |
| sp3d2 | октаэдрическая (SF6) | 90о |
Типы связи. Ковалентная связь, образованная однократным перекрыванием электронных облаков по линии, соединяющей центры взаимодействующих атомов, называется σ-связью. Связь, образованная перекрыванием атомных орбиталей по обе стороны линии, соединяющей ядра атомов (боковые перекрывания), называется π-связью.
Поляризуемостью связи называется способность связи становиться полярной или более полярной в результате действия внешнего электрического поля.
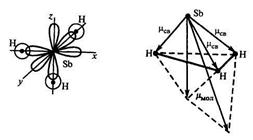
Пример 6. Определите пространственную структуру молекул SbH3 и BH3 и их полярность.
Р е ш е н и е. Связи в молекуле SbH3 образуются перекрыванием трёх р-орбиталей атома сурьмы (5s25p3) с тремя s-орбиталями трёх атомов водорода (1s1). Поскольку 3p-облака ориентированы в трёх взаимно перпендикулярных направлениях (по осям x,y,z), то связи в образовавшейся молекуле SbH3 направлены от вершины тригональной пирамиды, в которой находится атом сурьмы, к её основанию, в вершинах которого находятся атомы водорода. Следовательно, молекула SbH3 имеет
пирамидальную структуру.
Сумма векторов моментов диполей всех связей в молекуле SbH3 не равна нулю, и следовательно, молекула в целом полярна.

|
Ковалентные связи в молекуле BH3 образуются перекрыванием трёх гибридных орбиталей атома бора (2s12p2) с s-орбиталями трёх атомов водорода. Гибридные связи направлены под углом 120о. Ядра всех взаимодействующих атомов лежат в одной плоскости. Молекула имеет структуру плоского треугольника. Векторная сумма электрических моментов диполей связей в молекуле равна нулю, следовательно, молекула BH3 неполярна.
2 Ионная связь
Ионная связь образуется между атомами, сильно отличающимися друг от друга величиной электроотрицательности. Такая связь обусловлена электростатическим взаимодействием отрицательно и положительно заряженных ионов в химическом соединении.
Так как электрическое поле имеет сферический характер, то для ионной связи характерна ненасыщенность и ненаправленность. Чисто ионной связи не существует, говорят лишь о доле ионности связи.
3 Металлическая связь
Это химическая связь в металлах, где небольшое число электронов связывает большое число ядер атомов, а сами электроны могут перемещаться в металле. Таким образом, в металлах нелокализованная химическая связь. Это обусловливает их высокую электро- и теплопроводность, металлический блеск и др.
При сближении молекул появляется притяжение, что влечет за собой образование конденсированного (жидкого или твердого) состояния вещества. К основным видам межмолекулярного взаимодействия относятся вандерваальсовы силы, водородные связи и донорно-акцепторное взаимодействие.
1. Вандерваальсовы силы
Силы притяжения между молекулами, по предположению Ван-дер-Ваальса, названные вандерваальсовами силами, включают три составляющих:
Диполь-дипольное взаимодействие возикает при сближении полярных молекул ориентированных, чтобы положительная сторона одного диполя была направлена к отрицательной стороне другого диполя.
Индукционное взаимодействие возникает при воздействии диполя на неполярную молекулу, превращая её в индуцированный (наведенный) диполь. Между постоянным и наведенным диполем возникает притяжение.
Дисперсионное притяжение. В результате флуктуации электронной плотности появляются мгновенные диполи, которые в свою очередь индуцируют мгновенные диполи у соседних молекул, что вызывает дисперсионное притяжение. Движение мгновенных диполей согласовано, их появление и распад протекает синхронно.
2. Водородная связь
Химическая связь, образованная положительно поляризованным водородом молекулы А – Н и электроотрицательным атомом В другой или той же молекулы, называется водородной связью. Если водородная связь образуется между разными молекулами, она называется межмолекулярной; если связь образуется между двумя группами одной и той же молекулы, она называется внутримолекулярной. Водородная связь между молекулами обозначается тремя точками.
А – Н + В – R → А – Н ··∙ В – R
Энергия водородной связи возрастает с увеличением электроотрицательности и уменьшением размеров атома В.
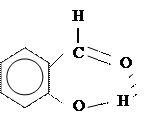
Водородная связь может возникнуть между атомами водорода и отрицательными атомами полярных групп в одной и той же молекуле, например в салициловом альдегиде:
3, Комплексные соединения
Сложные соединения, у которых имеются ковалентные связи, образованные по донорно-акцепторному механизму, называют комплексными или координационными соединениям.
CuSO4 + 4NH3 = [Cu(NH3)4]SO4
Согласно координационной теории Вернера, комплексные соединения состоят из внешней сферы и внутренней. Внутренняя сфера, или комплекс, включает центральный ион или атом, называемый комплексообразователем. Координируемые им ионы или молекулы называются лигандами. В рассмотренном выше примере комплексообразователем является ион меди, а лигандами – молекулы аммиака. Комплексообразователями являются атомы или ионы металлов, имеющие вакантные орбитали. Ионы или отдельные атомы ионов и молекул лигандов имеют неподеленные пары электронов.
Клатраты
Клатраты, или соединения включения, образуются в результате включения молекул «гостей» в полости кристалла, состоящего из частиц другого вида – «хозяев». К числу клатратов относятся газовые гидраты, клатраты мочевины и др.
В газовых гидратах в полостях кристаллов льда могут находиться молекулы, размеры которых лежат в диапазоне 0,32÷0,92 нм (N2, O2, C2H4, CO2, Cl2, H2S, Ar, Xe, CH4 и др.). Например, известны клатраты приблизительного состава СН4·6Н2О, в которых на 46 молекул воды приходится 8 полостей, занятых молекулами метана.
Кристаллическое состояние вещества
В зависимости от природы частиц, которые образуют кристаллическую решётку, различают ионные, атомные, молекулярные и металлические решётки.
В узлах ионной кристаллической решётки расположены положительные и отрицательные ионы. Такие решётки характерны для оксидов, гидроксидов и солей. Все ионные соединения имеют высокую температуру плавления и не летучи.
В узлах молекулярной кристаллической решётки располагаются полярные или неполярные молекулы. Они связаны между собой более слабыми силами, чем атомы или ионы. Поэтому вещества с молекулярной кристаллической решёткой имеют невысокую температуру плавления, они летучи. Например, сахар, камфара, вода, йод, аммиак, диоксид углерода (в твердом состоянии).
В узлах атомной кристаллической решётки располагаются атомы, связанные между собой электронными парами. Например, алмаз. Для веществ с атомной кристаллической решёткой характерны высокая твердость и высокая температура плавления.
В узлах металлической решётки располагаются нейтральные атомы и положительные ионы данного металла. Между ними свободно перемещаются электроны, что обусловливает общие свойства металлов: металлический блеск, пластичность, ковкость, электро- и теплопроводность.
Вариант 1.
3. Покажите распределение валентных электронов по орбиталям для каждого атома в молекулах PF5 и BeH2;
- определите механизм образования связи и её вид;
- определите полярность связи;
- укажите, имеет ли место гибридизация, и её вид;
- покажите геометрическую структуру молекул;
- определите полярность молекул.
4. Объясните с позиций метода ВС возможность образования молекулы C2N2.
Вариант 2.
3. Покажите распределение валентных электронов по орбиталям для каждого атома в молекулах H2Te и CF4;
- определите механизм образования связи и её вид;
- определите полярность связи;
- укажите, имеет ли место гибридизация, и её вид;
- покажите геометрическую структуру молекул;
- определите полярность молекул.
4. Объяснить с позиций метода ВС способность оксидов NO и NO2 образовывать димерные молекулы.
Вариант 3.
3. Покажите распределение валентных электронов по орбиталям для каждого атома в молекулах HBr и SiF4;
- определите механизм образования связи и её вид;
- определите полярность связи;
- укажите, имеет ли место гибридизация, и её вид;
- покажите геометрическую структуру молекул;
- определите полярность молекул.
4. У какого соединения С2Н5ОН или С2Н5SH выше температура кипения? Почему?
Вариант 4.
3. Покажите распределение валентных электронов по орбиталям для каждого атома в молекулах H2O и CCl4;
- определите механизм образования связи и её вид;
- определите полярность связи;
- укажите, имеет ли место гибридизация, и её вид;
- покажите геометрическую структуру молекул;
- определите полярность молекул.
4. Почему водородная связь оказывает влияние на свойства NH3, H2O и HF, но не оказывает заметного влияния на PH3, H2S и HCl?
Вариант 5.
3. Покажите распределение валентных электронов по орбиталям для каждого атома в молекулах PH3 и Br2;
- определите механизм образования связи и её вид;
- определите полярность связи;
- укажите, имеет ли место гибридизация, и её вид;
- покажите геометрическую структуру молекул;
- определите полярность молекул.
4. Как объяснить чрезвычайно большую растворимость в воде хлороводорода и аммиака – веществ со столь различной химической природой (при обычных условиях в 1 объеме воды растворяется 450 объемов HCl и 700 объемов NH3)?
Вариант 6.
3. Покажите распределение валентных электронов по орбиталям для каждого атома в молекулах AsH3 и H2S;
- определите механизм образования связи и её вид;
- определите полярность связи;
- укажите, имеет ли место гибридизация, и её вид;
- покажите геометрическую структуру молекул;
- определите полярность молекул.
4. Полярность связи в молекуле HF больше, чем в молекуле HCl. Тем не менее в воде HCl более сильная кислота. Почему?
Вариант 7.
3. Покажите распределение валентных электронов по орбиталям для каждого атома в молекулах CO2 и NCl3;
- определите механизм образования связи и её вид;
- определите полярность связи;
- укажите, имеет ли место гибридизация, и её вид;
- покажите геометрическую структуру молекул;
- определите полярность молекул.
4. Этанол кипит при 78°С. Почему температура кипения этантиола С2Н5SH ниже (37°С)?
Вариант 8.
3. Покажите распределение валентных электронов по орбиталям для каждого атома в молекулах CS2 и SO2;
- определите механизм образования связи и её вид;
- определите полярность связи;
- укажите, имеет ли место гибридизация, и её вид;
- покажите геометрическую структуру молекул;
- определите полярность молекул.
4. Из каких солей можно получить К3[Fe(CN)6]? Написать уравнение реакции.
Вариант 9.
3. Покажите распределение валентных электронов по орбиталям для каждого атома в молекулах SO2 и SO3;
- определите механизм образования связи и её вид;
- определите полярность связи;
- укажите, имеет ли место гибридизация, и её вид;
- покажите геометрическую структуру молекул;
- определите полярность молекул.
4. Какое основание является более сильным: Cu(OH)2 или комплексное [Cu(NH3)4]? Почему?
Вариант 10.
3. Покажите распределение валентных электронов по орбиталям для каждого атома в молекулах PH3 и SiH4;
- определите механизм образования связи и её вид;
- определите полярность связи;
- укажите, имеет ли место гибридизация, и её вид;
- покажите геометрическую структуру молекул;
- определите полярность молекул.
4. Пользуясь таблицей констант нестойкости, расположить в порядке повышения устойчивости следующие ионы:
[Cd(NH3)4]2+, [Cu(CN)4]2-, [Ag(NH3)2]+, [HgI4]2-.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 2446; Нарушение авторских прав?; Мы поможем в написании вашей работы!