
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Галогенопохідні ненасичених вуглеводнів
|
|
|
|
Ці сполуки можна розглядати як похідні ненасичених сполук, в яких один або кілька атомів Гідрогену заміщені атомами галогену. В залежності від розміщення галогену відносно подвійного зв’язку ці сполуки можна розділити на три типи.
1. Сполуки, в яких атом галогену міститься при одному з двох атомів карбону, які утворюють подвійний зв’язок СН2=СНHal.
2. Сполуки, в яких атом галогену міститься біля карбонового атома, суміжного з подвійним зв’язком, СН2=СН–CH2Hal.
3. Сполуки, в яких галоген відділений від подвійного зв’язку кількома карбоновими атомами, СН2=СН–(СН2)nHal.
У сполуках першого типу галоген надзвичайно міцно зв’язаний з карбоновим атомом і за звичайних умов не вступає, як правило, в реакції обміну, що пов’язано з взаємодією p-електронів подвійного зв’язку з вільними електронними парами атома галогену СН3=СНС1, при цьому С=С полімеризується, а зв’язок С–С зміцнюється.
У сполуках другого типу галоген, навпаки, більш рухомий, ніж у галогенопохідних насичених вуглеводнів, і легко заміщується іншими атомами та радикалами. В сполуках третього типу галоген має такі ж властивості, як і у галогенопохідних ненасиченого ряду.
Номенклатура і ізомерія. Для назв галогенопохідних алкенів, за женевською номенклатурою, до назви відповідного вуглеводню додають назву та число атомів галогенів, для визначення місця, що займають галогени в назві, вказують номера вуглецевих атомів, з якими зв’язані атоми галогенів, наприклад:
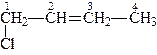
| 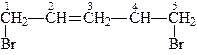
|
| 1-хлорбутен-2 | 1,5-дибромпентен-2 |
Поряд з женевською номенклатурою для назв галогенопохідних алкенів, головним чином таких, до складу молекул яких входить один атом галогену, використовують старі назви, які найчастіше утворюють від назв галогенів та назв радикалів, які з ними сполучені, наприклад:

| 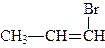
|
| хлористий вініл | бромистий пропеніл |
Ізомерія галогенопохідних алкенів залежить: 1) від ізомерії карбонового ланцюга; 2) від положення подвійного зв’язку в ланцюгу і 3) від положення галогенів.
Хлористий вініл, або монохлоретилен, СН2=СНС1. У промисловості хлористий вініл одержують гідрохлоруванням ацетилену в рідкій або в газовій фазі або дегідрохлоруванням дихлоретану. Найбільш поширеним методом добування хлористого вінілу є парофазне гідрохлорування ацетилену, яке провадять при 120 – 180°С над каталізатором, який являє собою активоване вугілля, просочене розчином сулеми.
Дегідрохлорування дихлоретану проводять дією спиртового розчину лугу при температурі близько 50°С. Хлористий вініл – безбарвний газ з слабким запахом, що нагадує запах хлороформу.
Полімер хлористого вінілу (полівінілхлорид) і продукти його співполімеризації з вінілацетиленом, хлористим вініліденом та іншими мономерами широко використовують для виготовлення штучної шкіри, електроізоляції, листових твердих і еластичних матеріалів для антикорозійних і водонепроникних покрить, плащів та інших виробів.
Хлористий аліл СН2=СН–СН2С1 добувають в техніці хлоруванням пропілену при температурі 400 – 500°С. Хлористий аліл – рідина із запахом, який нагадує запах гірчиці. Застосовується для добування гліцерину, є сировиною для виробництва лікарських препаратів та інсектицидів, клейових речовин та пом’якшувачів.
2-Хлорбутадіен-1,3 або хлоропрен, СН2=СС1–CH=CH2 – безбарвна рідина, яка кипить при 59°С. Його одержують приєднанням хлористого водню до вінілацетилену, який утворюється при полімеризації ацетилену. Хлоропрен легко полімеризується в каучукоподібну речовину, в зв’язку з цим його використовують у великих масштабах для виробництва синтетичного каучуку.
Поліхлорвінілові смоли добувають шляхом полімеризації хлористого вінілу в присутності органічних перекисів при 40°С і тиску 5,2 – 5,4 ат. у водних емульсіях. Великий інтерес являє собою недавно розроблений процес одержання поліхлорвінілових смол без застосування емульгатора. Цим способом можуть бути добуті більш тепло- та водостійкі смоли з кращими електроізоляційними властивостями, а також прозорі матеріали.
Поліхлорвінілові смоли з успіхом використовують для виготовлення лінолеумів, лінкрусту, плінтусів, плиток для підлоги і облицьовування стін, водопровідних і каналізаційних труб, у виробництві замінників шкіри, побутових виробів, ізоляційних матеріалів, штучного волокна, просочуваних тканин і т. ін.
Тетрафторетилен CF2=CF2 добувають піролізом монохлордифторметану без каталізатора при 650°С і тиску, близькому до атмосферного. Тетрафторетилен може бути добутий також взаємодією тетрафтордихлоретану з цинковим пилом в середовищі розчинника (метиловий або етиловий спирти, ацетон, діоксан) при 110 – 130°С і тиску до 40 ат. Тетрафторетилен – безбарвний газ, який застосовується для добування політетрафторетилену. Політетрафторетилен, або тефлон, добувають емульсійною полімеризацією тетрафторетилену при 70 – 80°С і тискові 40 – 100 ат. в присутності ініціаторів (органічні й неорганічні перекиси, персульфат калію та ін.)
Політетрафторетилен має дивні властивості. За своєю хімічною стійкістю він вищий золота і платини, не руйнується лугами, кислотами, на нього не діє “царська горілка”. Єдина речовина, яка руйнує тефлон, – металічний натрій, та й то при дуже високій температурі, фізико-хімічні властивості тефлону практично залишаються постійними при температурах від 60°С до +300°С. Завдяки малій текучості політетрафторетилен не можна переробляти пресуванням і відливанням під тиском. Застосовують політетрафторетилен для виготовлення неперевершених за хімічною стійкістю пластмас, що використовуються в електротехніці, в хімічному машинобудуванні та інших галузях промисловості.
|
|
|
|
|
Дата добавления: 2014-11-09; Просмотров: 2390; Нарушение авторских прав?; Мы поможем в написании вашей работы!