
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
План лекційного заняття
|
|
|
|
Основні поняття
Нітросполуки аліфатичного ряду
ЛЕКЦІЯ №8
Нітросполуки, ізомерія,нітроген, аліфатичні зв’язки, класифікація.
5. Нітросполуки аліфатичного ряду
6. Сульфурвмісні похідні аліфатичного ряду
7. Сульфокислоти і сульфохлориди
8. Аміни аліфатичного ряду
Література:
1. Ластухін Ю.О., Воронов С.А. Органічна хімія. – Львів: Центр Європи, 2001. – С. 71-127, 190-200.
2. Нейланд О.Я. Органическая химия. – М.: Высшая школа, 1990. – С. 9-13, 22-38, 59-61, 81-85, 86-89, 92-95, 103-105, 130, 145, 177-179, 225-228.
3. Перекалин В.В., Зонис С.А. Органическая химия. – М.: Просвещение, 1972. – С. 6-17, 18-25, 29-38, 47-48, 54-58, 76, 78-79, 105, 160-161, 177-179.
4. Петров А.А., Бальян Х.В., Трощенко А.Б. Органическая химия. – М.: Высшая школа, 1973. – С. 5-11, 20-43, 44-48, 64-65, 248-257.
5. Чирва В.Я., Ярмолюк С.М., Толкачова Н.В., Земляков О.Є. Органічна хімія. – Львів: БаК, 2009. – С. 81-131.
Конспект лекційного заняття:
Будова, ізомерія та класифікація нітросполук. Нітросполуками називаються сполуки, які містять одну або кілька нітрогруп – NО2, нітроген яких безпосередньо зв’язаний з карбоновими атомами молекули. В останній час будову нітросполук умовно виражають таким чином:

| 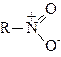
|
Як показали рентгеноскопічні дослідження, у нітрогрупі немає ні простого, ні подвійного зв’язку, а відбувається вирівнювання зв’язків, і розподілення електронної густини відповідає повній вирівнюваності зв’язків.
Гідрогеновий атом суміжної з нітрогрупою ланки ланцюга набуває значної рухомості, внаслідок чого “нітроформа” може переходити в “ациформу”, тобто в кислотну форму, яка утворює солі:
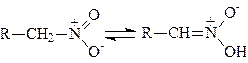 .
.
Ефіри азотистої кислоти мають спільну формулу R–О–NO, а нітросполуки R–NО2, отже, нітросполуки ізомерні ефірам азотистої кислоти.
За кількістю нітрогруп нітросполуки поділяють на моно-, ди-, тринітросполуки і т.д.
Мононітросполуки в залежності від того, з яким атомом вуглецю зв’язана нітрогрупа, поділяються на первинні, вторинні та третинні:

| 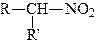
| 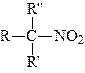
|
| первинні | вторинні | третинні |
Номенклатура. За женевською номенклатурою назви нітросполук виводять також від назв відповідних вуглеводнів, тільки перед назвою радикалів ставиться назва нітро-, наприклад:
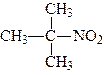
| 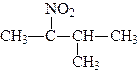
|
| 2-нітро-2-метилпропан | 2-нітро-3-метилбутан |
Способи добування. 1. Нітрування насичених вуглеводнів. Довгий час спроби ввести нітрогрупу у вуглеводні аліфатичного ряду прямою дією нітратної кислоти не давали результатів. У 1888 p. M.І. Коновалов установив, що нітросполуки аліфатичного ряду можуть бути одержані нагріванням у запаяних трубках насичених вуглеводнів з розведеною нітратною кислотою.
Нітрування супроводжується частковим окисленням первинних вуглеводнів в альдегіди і вторинних в кетони з подальшим утворенням відповідних карбонових кислот.
У 1934 p. П.П. Шоригін і О.В. Топчієв запропонували спосіб нітрування алканів у газовій фазі при температурі 150 – 475°С нітрогену (IV) оксидом, або парою нітратної кислоти. Зараз цей спосіб широко застосовується в техніці.
2. Дія азотистокислого срібла на галогеналкіли. У лабораторній практиці нітросполуки аліфатичного ряду добувають взаємодією галогеналкілу з азотистокислим сріблом:
 .
.
Утворення нітросполук, очевидно, проходить через стадії приєднання галогеналкілу і відщеплення галоїдної солі. Крім нітросполуки, при цьому утворюється значна кількість ізомерного ефіру азотистої кислоти.
Фізичні властивості. Нижчі гомологи мононітросполук – безбарвні рідини, важкорозчинні у воді, змішуються з спиртом і ефіром. Киплять при значно вищих температурах, ніж ефіри азотистої кислоти.
Хімічні властивості.
1. Відновлення. При відновленні нітросполук одержують первинні аміни:
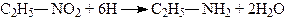 .
.
Утворення первинних амінів при відновленні нітросполук підтверджує, що в нітросполуках атом нітрогену нітрогрупи безпосередньо з’єднаний з атомом карбону алкілу. Навпаки, ізомерні нітросполукам ефіри азотистої кислоти, в яких алкіл з’єднаний з оксигеном, при тих же умовах проходження реакції відновлення перетворюються на спирти і виділяють аміак, або гідроксиламін. Спирти добувають також при омиленні ефірів азотистої кислоти лугами або кислотами; нітросполуки, навпаки, не омилюються.
2. Дія лугів. Нітросполуки ряду метану є нейтральними речовинами. Однак первинні й вторинні нітросполуки повільно розчиняються у розчинах лугів, утворюючи солі.
Первинні й вторинні нітросполуки аліфатичного ряду і їм подібні сполуки, які у вільному стані є нейтральними речовинами, але можуть з лугами утворювати солі ізомерних їм сильних кислот, називаються псевдокислотами.
3. Конденсація з альдегідами. У присутності лугів первинні й вторинні нітросполуки вступають у реакцію конденсації з альдегідами, наприклад:
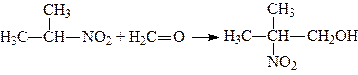 .
.
4. Дія азотистої кислоти, а) При дії азотистої кислоти на первинні нітросполуки добувають нігролові кислоти:
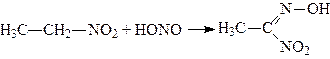 .
.
Нітролові кислоти при дії лугів переходять у солі (яскраво-червоного кольору).
б) При дії азотистої кислоти на вторинні нітросполуки утворюються псевдонітроли (зеленувато-синього кольору):
 .
.
в) Третинні нітросполуки не реагують з азотистою кислотою. Таким чином, з допомогою цієї реакції можна розрізняти первинні, вторинні й третинні нітросполуки.
Нітрометан CH3NO2 – безбарвна легкорухома рідина. В техніці добувають нітруванням метану, в лабораторії – взаємодією солі хлороцтової кислоти і нітрилу натрію у водному розчині. Застосовується нітрометан для добування хлорпікрину, нітроспиртів і т.п.
Трихлорнітрометан, або хлорпікрин, CCl3NО2 одержують дією білильного вапняку або хлору на пікринову кислоту. Хлорпікрин добувають прямим хлоруванням нітрометану у водному середовищі за наявності вуглекислого кальцію. Хлорпікрин – рухома безбарвна рідина з специфічним їдким запахом і температурою кипіння 112°. Отруйна пара його викликає сльозотечу. Застосовується хлорпікрин для дегазації зерносховищ, зерна і т.д.
Застосування. Нітросполуки жирного ряду застосовуються як розчинники деяких високомолекулярних сполук, лаків, фарб, а також використовуються як вихідні речовини для синтезу амінів, кислот, нітроспиртів та ін.
|
|
|
|
|
Дата добавления: 2014-11-09; Просмотров: 1007; Нарушение авторских прав?; Мы поможем в написании вашей работы!